Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Rak, živčni in imunski sistem – kako so med seboj povezani?
letnik 2025, številka 29
(v pripravi)
članki
Knjiga Kje so moji ključi kot primer narativne medicine
Zdenka Čebašek-Travnik, Saša Novak
Vpliv anestetikov na oksidativni stres
Katerina Tomsič, Alenka Nemec Svete
Rak, živčni in imunski sistem – kako so med seboj povezani?
Maja Čemažar, Tanja Jesenko, Urša Lampreht Tratar, Maša Omerzel
aktualno
kolofon
letnik 2025, številka 29
V zadnjem desetletju je prišlo do pomembnega premika v razumevanju vloge živčnega sistema pri raku, saj se je iz nekdaj pasivne, sekundarno prizadete strukture izkazal kot aktiven regulator tumorskega mikrookolja. S kompleksno dvosmerno komunikacijo med senzoričnimi, simpatičnimi in parasimpatičnimi živčnimi vlakni ter tumorskimi in imunskimi celicami vpliva na rast tumorja, imunski odziv, metastatske procese in odziv na zdravljenje. Sproščanje nevrotransmiterjev, nevropeptidov in rastnih dejavnikov iz živcev ter nevrotrofnih in vnetnih signalov iz tumorjev ustvarja povratne zanke, ki spodbujajo karcinogenezo in napredovanje bolezni. To je vodilo v razvoj novega interdisciplinarnega področja, nevrobiologije raka, ki odpira temelje za boljše razumevanje tumorske biologije in razvoj novih terapevtskih pristopov 1.
Nevroni kot promotorji rasti tumorjev in metastaz
Delovanje nevronov je izredno pomembno pri urejanju imunskega odziva in povečanju zmožnosti tumorskih celic, da ubežijo imunskemu nadzoru 2. Nevronska aktivnost prispeva k razvoju in rasti tumorja z različnimi mehanizmi, kot so neposredna interakcija s tumorskimi celicami ali posredna z modulacijo imunskega sistema ali sprememb v ožiljenosti tumorjev.
Neposredna interakcija nevronov s tumorskimi celicami temelji predvsem na delovanju nevrotransmiterjev in nevrotrofičnih dejavnikov, ki jih izločajo živčna vlakna ter se vežejo na specifične receptorje na tumorskih celicah, s čimer neposredno vplivajo na njihovo rast, preživetje in invazivni potencial. Nevrotransmiterji, kot so adrenalin, norepinefrin (noradrenalin), dopamin in acetilholin, skupaj z nevrotrofičnimi dejavniki, kot so možganski nevrotrofični dejavnik (BDNF), živčni rastni dejavnik (NGF) ter nevrogeni kemokini (npr. CXCL12, CX3CL1), se lahko vežejo na ustrezne receptorje na tumorskih celicah. Ta vezava nato sproži znotrajcelično signalno kaskado, ki vpliva na rast tumorjev, invazijo in metastaziranje. Tumorske celice pogosto izkazujejo nepravilnosti v izražanju in delovanju ionskih kanalov ter receptorjev za nevrotransmiterje, kar jih naredi dovzetnejše za modulacijo prek živčnih signalov iz tumorskega mikrookolja. Tako lahko na primer nevrotransmiter glutamat aktivira receptorje tipa NMDA (NMDAR) na tumorskih celicah, kar vodi v aktivacijo signalne poti MEK-MAPK in posledično v pospešeno rast tumorja in metastaziranje 3.
Poleg neposrednih učinkov na tumorske celice živčni sistem pomembno prispeva k razvoju in napredovanju raka tudi posredno, z modulacijo ključnih komponent tumorskega mikrookolja, zlasti imunskega sistema, angiogeneze in metastatskih procesov.
Posredni vpliv nevronov na rast tumorjev prek imunskega sistema
Živčevje lahko prispeva k rasti tumorjev prek imunskega sistema z vplivom na številne imunske celice, predvsem z zaviranjem protitumorskega imunskega odziva, kar omogoča imunski pobeg tumorskih celic. Nevronski signali vplivajo na številne imunske celične populacije v tumorskem mikrookolju, med katerimi so posebej pomembne naslednje:
- Citotoksični limfociti T (CD8+): nevtrotransmiterji, kot sta acetilholin in GABA, pomembno vplivajo na delovanje citotoksičnih limfocitov T. Acetilholin lahko s povečanjem izražanja liganda PDL1 na tumorskih celicah posredno povzroči inhibicijo CD8+ celic, kar vodi v inhibicijo odziva celic T. GABA z aktivacijo receptorja GABAb na tumorskih celicah sproži signalne kaskade, ki povečajo proliferacijo tumorskih celic ter hkrati zmanjšajo infiltracijo limfocitov CD8+ v tumorsko mikrookolje 4.
- S tumorjem povezani makrofagi (TAM): ob sproščanju norepinefrina, ki se veže na β2 adrenergični receptor (ADRB2) na TAM, pride do povečanja imunosupresivnih in protumorskih dejavnikov, kot sta interlevkin 10 (IL-10) in arginaza 1 (ARG1), ki inhibirata metabolizem celic T. Poleg tega norepinefrin zmanjšuje produkcijo proinflamatornih citokinov, kot so dejavnik tumorske nekroze α (TNFα), IL-1β in IL-12, kar dodatno oslabi protitumorski imunski odziv in spodbuja napredovanje bolezni 5.
- Regulatorne celice T (Treg): podobno kot pri TAM, norepinefrin povzroči povečano migracijo ter supresivno delovanje celic Treg v tumorskem mikrookolju. Celice Treg so znane kot imunosupresivne celice, ki uravnavajo in zmanjšujejo protitumorski imunski odziv z izločanjem imunosupresivnih citokinov, kot so TGFβ, izločanja IL-10 in IL-35. Poleg tega Treg posredno blokirajo aktivacijo limfocitov T s kompetitivno vezavo na receptorje CD80/CD86 na antigen predstavitvenih celicah 6.
- Nevtrofilci: kronični stres aktivira simpatični živčni sistem, kar vodi v povečano signalizacijo prek β-adrenergičnih receptorjev. Posledično tumorske celice izločajo eksosome, obogatene s transkripcijskim dejavnikom SP1, ki se veže na receptor TLR4 na nevtrofilcih. Aktivacija signalne poti TLR4/NF-κB sproži izločanje IL-1β, ki posredno spodbuja metastaziranje z aktivacijo signalnih poti PI3K/AKT in MEK/ERK v tumorskih celicah. To vodi v hibridni epitelno-mezenhimski fenotip z večjo plastičnostjo in s tem povečano metastatsko sposobnostjo 7.
- Celice NK: imajo ključno vlogo v prirojenem protitumorskem imunskem odzivu, vendar je njihova aktivnost lahko zavrta zaradi interakcij z nevroni v tumorskem mikrookolju. Senzorični nevroni sproščajo nevrotransmitor CGRP, ki se veže na receptorja RAMP1 in CALCRL na fibroblastih. To aktivira signalno pot cAMP/PKA ter zmanjša izločanje IL-15, ključnega citokina za preživetje in aktivacijo celic NK 8.
Posredni vpliv nevronov na rast tumorjev prek angiogeneze in metastaziranja
Nevronska aktivnost pomembno vpliva na tumorsko mikrookolje, zlasti na angiogenezo in metastaziranje. Norepinefrin, ki se sprošča iz živčnih vlaken, aktivira β2-adrenergične receptorje (ADRB2) na endotelnih celicah, kar povzroči presnovni premik proti aerobni glikolizi in spodbuja angiogenezo v tumorskem mikrookolju 9. Poleg vpliva na proliferacijo tumorskih celic nevroni pomembno prispevajo tudi k metastaziranju. Z izločanjem nevrotransmiterjev in nevrotrofičnih dejavnikov omogočajo neposredno komunikacijo s tumorskimi celicami ter povečujejo njihovo malignost. Norepinefrin lahko na primer poveča izražanje telomerazne podenote hTERT po signalni poti β2-AR/PAK/c-MYC/HIF-1α in sproži epitelijsko-mezenhimski prehod (EMT). Tumorske celice lahko tvorijo tudi specializirane strukture, kot so tumorski mikrotubuli (TM) in tunelski nanotubuli (TNT), ki omogočajo medcelično komunikacijo, invazijo, rezistenco proti zdravljenju in metastaziranje 10. Pri gliomih imajo pri tem pomembno vlogo z nevroni povezani proteini, kot je GAP-43. Pomemben prispevek k tumorski invaziji imajo tudi glialne celice, zlasti Schwannove celice, ki v tumorskem mikrookolju preidejo v regeneracijski fenotip ter aktivno podpirajo invazijo in perinevralno širjenje tumorja.
Kako tumor vpliva na živčevje?
Izločanje nevrotrofičnih dejavnikov
Tumorji niso zgolj pasivni prejemniki živčnih signalov, ampak aktivno inducirajo spremembe v živčnem sistemu. Pomemben mehanizem te interakcije predstavlja izločanje nevrotrofičnih dejavnikov in molekul za usmerjanje aksonov, ki spodbujajo rast živčnih vlaken in aksonogenezo ter s tem neposredno preoblikujejo tumorsko mikrookolje 11. Ti dejavniki prispevajo k izraščanju novih senzoričnih in simpatičnih živčnih vlaken znotraj tumorskega tkiva, kar funkcionalno povezuje tumor z živčnim sistemom. Nevrotrofični dejavniki, zlasti NGF in BDNF, imajo ključno vlogo pri spodbujanju rasti in diferenciacije nevronov. NGF, nujen za razvoj in preživetje nevronov, je v tumorskih celicah prekomerno izražen in povezan z napredovanjem bolezni 12. BDNF spodbuja rast, diferenciacijo in zorenje centralnih in perifernih nevronov.
Izražanje NGF in BDNF je močno povezano z večjo živčno gostoto simpatičnih živčnih vlaken, kar so opazili pri različnih tumorjih, med njimi v tumorjih dojke, mehurja, prostate, glave in vratu ter pankreasa 13. S povečevanjem tumorske mase se nova živčna vlakna lahko razraščajo proti centralnemu živčnemu sistemu in se vanj funkcionalno vključujejo. Povečana živčna gostota v tumorjih in izražanje nevrotrofinov sta lahko povezana s slabšo prognozo bolezni, saj lahko znotraj tumorja vzpostavlja pozitivno povratno zanko, v kateri lahko novonastalo živčevje dodatno spodbuja rast, invazivnost in napredovanje raka 14.
Izločanje molekul za usmerjanje aksonov
Poleg nevrotrofičnih dejavnikov imajo ključno vlogo pri navzkrižni komunikaciji med tumorjem in živčevjem molekule za usmerjanje aksonov (Slika 1). Te molekule, ki so bile sprva opisane zaradi svoje vloge pri usmerjanju rasti aksonov, so danes znane kot tesno povezane z razvojem in napredovanjem tumorjev. Med glavne družine molekul za usmerjanje aksonov sodijo pleksini/semaforini, eritropoetin producirajoči hepatocelularni karcinom (Eph) in z njim povezani receptorji iz družine Eph (efrini), netrini in njihovi receptorji ter signalna os Slit–Robo 13. Vse te molekule so izražene v različnih malignih obolenjih in prispevajo k invaziji, migraciji in metastaziranju rakavih celic.
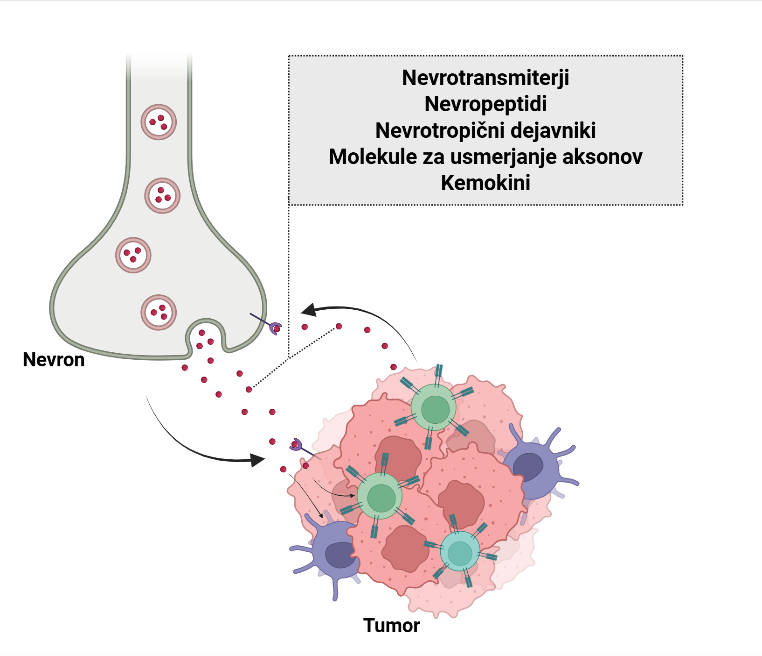
Slika 1: Shematski prikaz dvosmerne komunikacije med živčevjem in tumorjem (ustvarjeno s programom BioRender). Živčne celice v tumorskem mikrookolju izločajo signalne molekule, ki spodbujajo proliferacijo tumorskih celic, povečujejo njihov invazivni in metastatski potencial ter hkrati vplivajo na delovanje imunskih celic, kar prispeva k imunski supresiji v tumorju. V pozitivni povratni zanki tumorske celice izločajo dejavnike, ki pospešujejo rast živčnih vlaken in vodijo v povečano živčno gostoto znotraj tumorja.
Nevronska mimikrija tumorskih celic
Nekatere tumorske celice pridobijo lastnosti živčnih celic, tvorijo sinaptične povezave in uporabljajo nevrotransmiterske receptorje (npr. NMDAR), kar prispeva k metastatskemu potencialu, posebno v možganih 14. Dokazano je bilo, da lahko tumorske celice raka dojk izkoristijo signalne poti prek glialnega nevrotrofičnega dejavnika (GDNF) za metastaziranje iz kosti v meninge. Ta odkritja odpirajo možnosti novih terapevtskih pristopov z zdravili, ki se uporabljajo za zdravljenje nevroloških motenj 15.
Terapevtske priložnosti: farmakološki in nefarmakološki pristopi
Poznavanje prepletenosti živčnega sistema s tumorji odpira nova vrata za terapevtske možnosti, ki ciljajo živčno-tumorske interakcije. Delimo jih na farmakološke in nefarmakološke pristope 13 16. Med farmakološkimi so med najbolje raziskanimi skupinami β-adrenergični blokatorji (neselektivni β-blokatorji, npr. propranolol). Z zaviranjem β2-adrenergičnih receptorjev zmanjšujejo adrenergično posredovano proliferacijo, angiogenezo in imunosupresijo v tumorskem mikrookolju, s tem pa povečajo infiltracijo limfocitov T CD8+ in izboljšajo učinkovitost imunoterapije (anti-PD-1, anti-CTLA-4). Klinične študije pri bolnikih z metastatskim melanomom so pokazale, da je dodajanje neselektivnega zaviralca β-adrenergičnega blokatorja k imunoterapiji izboljšalo stopnje preživetja 13.
Pomembno tarčo predstavlja tudi signalna pot peptida, povezanega s kalcitoninskim genom (CGRP). Antagonisti CGRP, ki se sicer uporabljajo pri zdravljenju migrene (npr. rimegepant), so v eksperimentalnih modelih pokazali sposobnost zaviranja rasti melanoma in tumorjev glave in vratu. Mehanizem je povezan z zmanjšano nevroimunsko imunosupresijo, saj CGRP vpliva na fibroblaste, NK-celice in nociceptorne nevrone ter s tem spodbuja tumorsko rast in bolečino.
Zaviralci receptorja nevrokinin-1 (NK-1R, npr. aprepitant) imajo dokazano protitumorsko delovanje z blokado signalizacije substance P, ki je vključena v proliferacijo, angiogenezo in metastatski potencial številnih tumorjev. Aprepitant, ki se v klinični praksi že uporablja kot antiemetik, je v in vitro in in vivo študijah ter v kombinaciji z radioterapijo pri bolniku s pljučnim karcinomom pokazal izrazite protitumorske učinke brez neželenih učinkov 17.
Antagonisti metabotropnega glutamatnega receptorja mGluR1 predstavljajo privlačno tarčo za zdravljenje številnih rakov, saj je mGluR1 pogosto prekomerno izražen v tumorskih celicah, njegovo zaviranje pa vodi v zaviranje celične proliferacije in indukcijo apoptoze. Zaviralci muskarinskih receptorjev (zlasti M3) so še ena obetavna skupina, saj številni tumorji, kot so pljučni in rak debelega črevesa in danke, melanom, rak trebušne slinavke in dojke, izkoriščajo holinergično signalizacijo za rast in invazijo 18.
Nefarmakološki nevromodulatorni pristopi
Poleg zdravil se vse več pozornosti namenja nefarmakološkim metodam, ki delujejo z modulacijo avtonomnega in senzoričnega živčnega sistema. Akupunktura in akupresura zmanjšujeta bolečino, utrujenost in druge spremljajoče simptome raka, pri čemer delujeta z aktivacijo endogenih analgetičnih poti, modulacijo serotoninskih in opioidergičnih sistemov ter vplivata na vnetne mediatorje. Transkutana električna stimulacija akupunkturnih točk (TEAS) predstavlja neinvazivno alternativo, ki prav tako zmanjša bolečino in ugodno vpliva na imunske parametre. Pomemben del sodobnega pristopa pa predstavljajo tudi psihološki in vedenjski ukrepi, kot so obvladovanje stresa, kognitivno-vedenjska terapija, meditacija in telesna aktivnost, denimo joga 13.
Zaključek
Živčni sistem je postal ena ključnih novih razsežnosti pri razumevanju tumorske biologije, ki je bila dolga leta zanemarjena, saj je veljalo prepričanje, da živci igrajo vlogo pasivnega tkiva. Sedaj vemo, da je komunikacija med tumorjem in živčnim sistemom obojestranska in vodi v rast in napredovanje tumorja. Povezave med živčnimi, tumorskimi in imunskimi celicami imajo pomemben vpliv na karcinogenezo, metastaziranje in odzivnost na terapije. Nevropeptidi in kateholamini usmerjajo tumorsko mikrookolje v stanje imunosupresije, povečujejo izčrpanost celic T in promovirajo tumorsko napredovanje. Novi načini zdravljenja, ki ciljajo živčno signalizacijo, od farmakoloških do vedenjskih, predstavljajo izjemno obetaven pristop za prihodnost, zlasti za tumorje, ki so imunsko »hladni« in so odporni proti sedanjim oblikam imunoterapije.
-
___
-
Amit, M. et al. Neuro-immune cross-talk in cancer. Nat Rev Cancer 25, 573–589 (2025). ↩
-
Balood, M. et al. Nociceptor neurons affect cancer immunosurveillance. Nature 611, 405–412 (2022). ↩
-
Allen, J. K. et al. Sustained Adrenergic Signaling Promotes Intratumoral Innervation through BDNF Induction. Cancer Res 78, 3233–3242 (2018). ↩
-
Wang, Z., Liu, W., Wang, C., Li, Y. & Ai, Z. Acetylcholine promotes the self-renewal and immune escape of CD133+ thyroid cancer cells through activation of CD133-Akt pathway. Cancer Lett 471, 116–124 (2020). ↩
-
Qin, J. F. et al. Adrenergic receptor β2 activation by stress promotes breast cancer progression through macrophages M2 polarization in tumor microenvironment. BMB Rep 48, 295–300 (2015). ↩
-
Cervantes-Villagrana, R. D., Albores-García, D., Cervantes-Villagrana, A. R. & García-Acevez, S. J. Tumor-induced neurogenesis and immune evasion as targets of innovative anti-cancer therapies. Signal Transduct Target Ther 5, (2020). ↩
-
Pan, J. et al. Chronic stress induces pulmonary epithelial cells to produce acetylcholine that remodels lung pre-metastatic niche of breast cancer by enhancing NETosis. J Exp Clin Cancer Res 42, (2023). ↩
-
Wang, K. et al. Nociceptor neurons promote PDAC progression and cancer pain by interaction with cancer-associated fibroblasts and suppression of natural killer cells. Cell Res 35, 362–380 (2025). ↩
-
Zahalka, A. H. et al. Adrenergic nerves activate an angio-metabolic switch in prostate cancer. Science 358, 321–326 (2017). ↩
-
Guan, F. et al. Mitochondrial transfer in tunneling nanotubes-a new target for cancer therapy. J Exp Clin Cancer Res 43, (2024). ↩
-
Magnon, C. & Hondermarck, H. The neural addiction of cancer. Nat Rev Cancer 23, 317–334 (2023). ↩
-
Ferraguti, G. et al. Nerve Growth Factor and the Role of Inflammation in Tumor Development. Curr Issues Mol Biol 46, 965–989 (2024). ↩
-
Huang, S., Zhu, J., Yu, L., Huang, Y. & Hu, Y. Cancer-nervous system crosstalk: from biological mechanism to therapeutic opportunities. Mol Cancer 24, (2025). ↩
-
Renz, B. W. et al. β2 Adrenergic-Neurotrophin Feedforward Loop Promotes Pancreatic Cancer. Cancer Cell 33, 75–90.e7 (2018). ↩
-
Ren, L. et al. Sensory neurons drive pancreatic cancer progression through glutamatergic neuron-cancer pseudo-synapses. Cancer Cell 43, (2025). ↩
-
Bloomer, H., Dame, H. B., Parker, S. R. & Oudin, M. J. Neuronal mimicry in tumors: lessons from neuroscience to tackle cancer. Cancer Metastasis Rev 44, (2025). ↩
-
Pu, T., Sun, J., Ren, G. & Li, H. Neuro-immune crosstalk in cancer: mechanisms and therapeutic implications. Signal Transduct Target Ther 10, (2025). ↩
-
Muñoz, M. & Coveñas, R. The Neurokinin-1 Receptor Antagonist Aprepitant: An Intelligent Bullet against Cancer? Cancers (Basel) 12, 2682 (2020). ↩
Prof. dr. Maja Čemažar
Viš. znan. sod. dr. Tanja Jesenko
Doc. dr. Urša Lampreht Tratar
Doc. dr. Maša Omerzel
Onkološki inštitut Ljubljana