Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Vpliv RNA in celičnih organelov na nastanek proteinskih kondenzatov v celicah
letnik 2023, številka 25
(v pripravi)
članki
Urban Košak, Damijan Knez, Anže Meden, Simon Žakelj, Jurij Trontelj, Jure Stojan, Maja Zakošek Pipan, Kinga Sałat idr.
zdravje
Novi povzetki raziskav o zdravju možganov – marec 2024
Tina Giber, Lana Blinc, Maja Bresjanac
kolofon
letnik 2023, številka 25
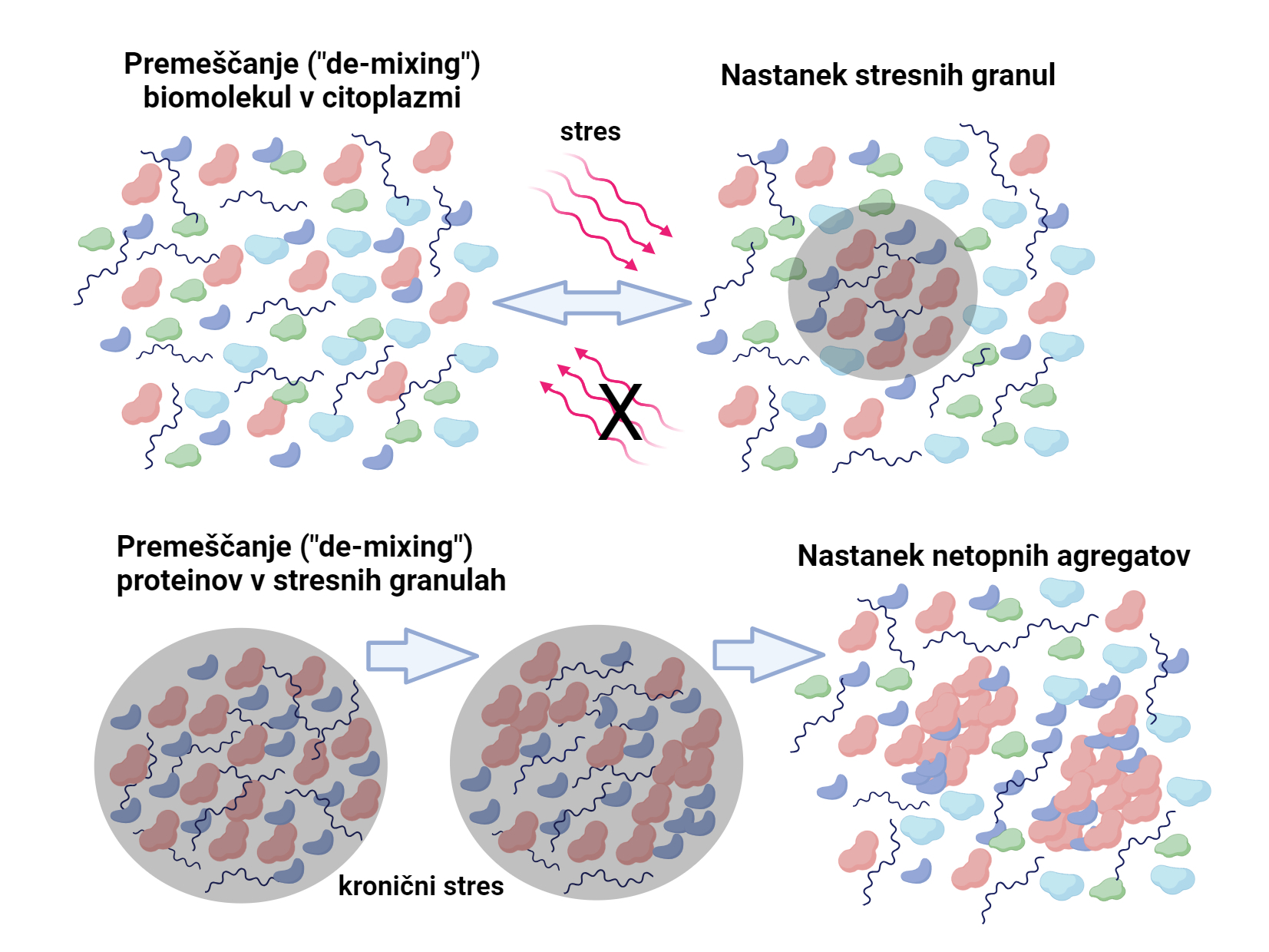
Med 6. in 8. septembrom 2023 se je v Trstu pod pokroviteljstvom International Centre for Genetic Engineering and Biotechnology (ICGEB) odvijala mednarodna konferenca Arturo Falaschi na temo Funkcije in nefunkcionalnosti proteina TDP43 v nevrodegenerativnih obolenjih. Na njej je bil velik del predstavitev uglednih raziskovalcev namenjen raziskavam fazne separacije RNA-vezavnih proteinov, njihovi kondenzaciji in premeščanju (ang. »de-mixing«), predvsem v stresnih granulah, kar vodi v tvorbo netopnih agregatov in odmiranje nevronov. V tem prispevku povzemamo značilnosti stresnih granul (celični proteinski kondenzati nizke gostote), nedavno objavljenih v reviji Nature Communications 1.
Jedrca se razlikujejo od jedrnih telesc in stresnih granul po gostoti (refrakcijskem indeksu)
Razdelitev znotrajceličnega prostora celica uporablja za nadzor nad organizacijo in izvedbo niza kompleksnih bioloških procesov, nujnih za življenje. Notranjost ali citoplazmo celice zapolnjujejo membranski predelki ali organeli, in številni ne-membranski organeli ali biomolekularni kondenzati, z značilnim dinamičnim nastankom in razgradnjo 2 3. Med ne-membranske organele v celicah prištevamo tudi jedrna telesca in stresne granule. Slednje se značilno formirajo v citoplazmi celic med zgodnjim odzivom celic na stres. Ob stresu se v nastalih stresnih granulah začasno lokalno skladiščijo različne RNK in proteini, kar zavre de novo sintezo proteinov, hkrati pa vse te biomolekule zaščiti pred znotrajcelično razgradnjo. Ob prekinitvi stresa in posledični razgradnji stresnih granul so te komponente znova zelo hitro na voljo za sintezo proteinov, okrevanje celic in vzpostavitev normalne homeostaze 4. Tekočinam podobne lastnosti teh ne-membranskih skupkov biomolekul, pogosto imenovanih tudi kondenzati, govorijo v prid hipoteze, da nastanejo z ločitvijo faz tekoče-tekoče v tekočem okolju (ang. »Liquid-Liquid Phase Separation, LLPS«) 3. Z biofizikalnega vidika znotrajcelične kondenzate biomolekul opredeljuje okrogla morfologija, njihova značilna rast z zlivanjem kapljic in dinamična izmenjava notranjih komponent z okoliško tekočino, na kar lahko vplivajo različni zunanji in notranji stresni dražljaji 5 6. Biomolekularni kondenzati imajo ključno vlogo pri organizaciji celičnih reakcij saj omogočajo lokalno natančno koncentriranje specifičnega niza biomolekul. Ob tem se poraja vprašanje, če tvorbo kondenzatov spremlja točkovno povečanje gostote (mase) teh biomolekul znotraj različnih biomolekul polne citoplazme. Tomografska analiza refrakcijskega indeksa v 3D-strukturah in sočasno imunocitokemijsko barvanje celic za prisotnost ne-membranskih organelov, kot so jedrca, jedrna telesca in citoplazemske stresne granule, sta potrdili, da jedrca tvorijo kondezate z višjo gostoto, kot je okoliška plazma v jedru (nukleoplazma), medtem ko po refrakcijskem indeksu kondenzatov jedrnih telesc ne moremo ločiti od okoliške nukleoplazme in stresnih granul od citoplazme 3. Gre namreč za strukture nizke gostote s podobno skupno masno koncentracijo proteinov, kot jo ima okoliška nukleoplazma oziroma citoplazma. Kako pa te strukture nastanejo? Notranjost celice je zelo natrpano okolje, zapolnjeno s citosolnimi proteini, katerih ocenjena koncentracija se giblje okrog 3 mM 7. Do nastanka kondenzata podobne gostote v takem okolju lahko pride s procesom premeščanja biomolekul (ang. »de-mixing«), kjer zaradi medmolekularnih povezav in prerazporeditev pride do lokalnih sprememb sestave tekoče faze, ne pride pa do spremembe lokalne masne koncentracije 8 9. Ta proces naj bi omogočal nastanek kondenzatov z nizko gostoto, kot so jedrna telesa in stresne granule, s skupno masno koncentracijo podobno nukleoplazmi in citoplazmi 1.
RNK ogrodje omogoča poroznost in prepustnost kondenzatov
Stresne granule (celični proteinski kondenzati nizke gostote) so se v objavljeni raziskavi 1 izkazale kot prepustne za različne majhne proteine, ki so vanje prosto prehajali oz. iz njih izhajali. Raziskava je potrdila, da biomolekularno gostoto jedrnih telesc in stresnih granul v jedru in citoplazmi uravnava prisotnost molekul RNK. Kako pa uspe RNK znižati biomolekularno gostoto kondenzatov? V kondenzatih nizke gostote RNK deluje kot ogrodje, na katero se vežejo različni RNK-vezavni proteini, s katerimi RNK tvori molekularno mrežo, na katero se preko protein-protein in protein-RNK interakcij nato namestijo različne ostale biomolekule iz jedra ali citoplazme. Prisotnost RNK je nujna za poroznost kondenzatov saj uravnava njihov nastanek in razgradnjo. Raztegnjena polimerna struktura RNK namreč ublaži potrebo po tesnih interakcijah med proteini, ki bi sicer povečali gostoto kondenzata. V primeru izgube/odstranitve RNK-ogrodja v kondenzatih praviloma pride do zgoščevanja prisotnih biomolekul in povečanja gostote kondenzata. V nadaljevanju lahko tesnejše interakcije med biomolekulami, njihovo prileganje (oligomerizacija), povzroči premeščanje le-teh znotraj kondenzata na rob ali celo izven kondenzata v netopni obliki 1.
Zaključek
S prikazanim mehanizmom je mogoče razložiti nastanek stresnih granul in njihov prehod v toksične netopne agregate, ki povzročajo odmiranje nevronov pri nevrodegenerativnih obolenjih. Dejstvo, da na dinamiko nastajanja stresnih granul v celici vplivajo tudi membranski celični organeli, ki v svoji bližnji okolici ne omogočajo nastanka večjih biomolekularnih kondenzatov 1, nakazuje smer prihodnjih raziskav, ki se bodo najverjetneje osredotočale na obnašanje biomolekul v kondenzatih, njihovo interakcijo z bližnjo okolico, in na vpliv njihovega premeščanja na funkcije v celici.
-
___
-
Kim T, Yoo J, Do S, Hwang DS, Park Y, Shin Y. RNA-mediated demixing transition of low-density condensates. Nat Commun. 2023;14(1):2425. doi:10.1038/s41467-023-38118-z ↩
-
Banani SF, Lee HO, Hyman AA, Rosen MK. Biomolecular condensates: organizers of cellular biochemistry. Nat Rev Mol Cell Biol. 2017;18(5):285-298. doi:10.1038/nrm.2017.7 ↩
-
Shin Y, Brangwynne CP. Liquid phase condensation in cell physiology and disease. Science. 2017;357(6357). doi:10.1126/science.aaf4382 ↩
-
Matheny T, Van Treeck B, Huynh TN, Parker R. RNA partitioning into stress granules is based on the summation of multiple interactions. RNA. 2021;27(2):174-189. doi:10.1261/rna.078204.120 ↩
-
Brangwynne CP, Mitchison TJ, Hyman AA. Active liquid-like behavior of nucleoli determines their size and shape in Xenopus laevis oocytes. Proc Natl Acad Sci U S A. 2011;108(11):4334-4339. doi:10.1073/pnas.1017150108 ↩
-
Wheeler JR, Matheny T, Jain S, Abrisch R, Parker R. Distinct stages in stress granule assembly and disassembly. Elife. 2016;5. doi:10.7554/eLife.18413 ↩
-
Milo R. What is the total number of protein molecules per cell volume? A call to rethink some published values. Bioessays. 2013;35(12):1050-1055. doi:10.1002/bies.201300066 ↩
-
Espinosa JR, Joseph JA, Sanchez-Burgos I, Garaizar A, Frenkel D, Collepardo-Guevara R. Liquid network connectivity regulates the stability and composition of biomolecular condensates with many components. Proc Natl Acad Sci U S A. 2020;117(24):13238-13247. doi:10.1073/pnas.1917569117 ↩
-
Shin Y. Rich Phase Separation Behavior of Biomolecules. Mol Cells. 2022;45(1):6-15. doi:10.14348/molcells.2021.0204 ↩
Dr. Helena Motaln
Odsek za Biotehnologijo
Inštitut Jožef Stefan
Ljubljana, Slovenia
Sprejeto: 12.11.2023
Objavljeno: 29.11.2023