Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Razlike med spoloma pri Parkinsonovi bolezni
letnik 2017, številka 14
uvodnik
Maša Čater
članki
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
aktualno
Vesna M. van Midden, Dolores Trol
Poročilo z javnega posveta ob zaključku projekta Z možgani za možgane
Sebastijan Krajnc
kolofon
letnik 2017, številka 14
Parkinsonova bolezen (PB) je druga najpogostejša nevrodegenerativna bolezen, za Alzheimerjevo boleznijo na prvem mestu. V zadnjih letih so pritegnile pozornost razlike med spoloma pri nevroloških boleznih. Razlike so prisotne v prevalenci bolezni, kliničnih simptomih, odgovoru na zdravljenje in v izidu bolezni. Posledično je spol sedaj prepoznan kot pomemben dejavnik klinične in demografske heterogenosti PB. Poznati raznolikost bolezni pomeni razumeti patogenezo bolezni in bi pomenilo korak bližje k posamezniku prilagojeni terapiji.
V Sloveniji imamo 7000 pacientov s Parkinsonovo boleznijo, v svetu število naraste na 6,3 milijone 1. Glavna patološka značilnost bolezni je izguba dopaminskih nevronov v predelu črnega jedra (substantia nigra, SN) in posledično upad koncentracije dopamina v striatumu.
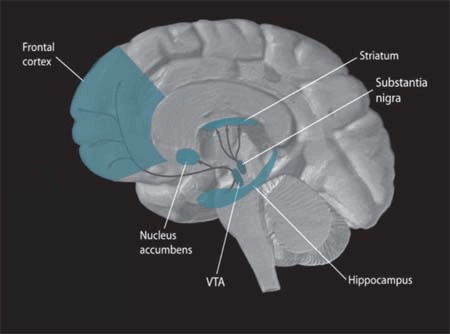
Slika 1. Dopaminska nigrostriatalna pot: telesa dopaminskih nevronov ležijo v substantii nigri in njihovi aksoni se raztezajo v striatum. Vir: WIkimedia Commons.
Najznačilnejši motorični znaki bolezni so tremor, rigidnost, bradikinezija ali hipokinezija in posturalna nestabilnost 2. Že pred nastopom motoričnih simptomov so lahko prisotni tudi nemotorični simptomi bolezni, kot so depresija, kognitivne motnje, motnje v avtonomnih funkcijah in težave s spanjem 3. Vse bolj prihajajo v ospredje opažanja, da je PB zelo raznolika bolezen. Različna je prisotnost motoričnih in nemotoričnih simptomov med pacienti, hitrost napredovanja bolezni in nastanek zapletov motoričnih simptomov ob zdravljenju z dopaminergičnimi zdravili 4 5 6. Heterogenost bolezni bi lahko bila posledica genetskih dejavnikov, izpostavljenosti dejavnikom okolja, prisotnosti pridružene druge možganske patologije ali razlik v zmožnosti kompenzacije bolezni pri prizadetih posameznikih 5.
Kot pomemben dejavnik zgoraj omenjenih razlik je sedaj prepoznan tudi spol pacienta. Razlike so prisotne v prevalenci bolezni, kliničnih simptomih, odgovoru na zdravljenje in v izidu bolezni 7. Epidemiološke študije so večkrat pokazale, da sta tako prevalenca kot incidenca PB 1,5-krat do 2-krat višji pri moških kot pri ženskah 8. Razmerje incidence moških napram ženskam se z leti zmanjšuje 9 10. Dodatno so nekatere raziskave pokazale, da so ob nastopu prvih simptomov bolezni ženske v povprečju dve leti starejše od moških 11. Ob postavitvi diagnoze so ženske po klinični lestvici Združena ocenjevalna lestvica za Parkinsonovo bolezen (ang. Unified Parkinson’s Disease Rating Scale, UPDRS) motorično manj prizadete kot moški 12. Vse to nakazuje, da so morda ženske v začetku bolezni bolj zaščitene ali pa bolje kompenzirajo izgubo dopaminskih nevronov kot moški. Z metodo SPECT (ang. single photon emission computer tomography), kjer je izmerjena raven dopamina v nigrostriatalnih sinapsah, so ugotovili, da imajo ženske v zgodnji fazi bolezni višjo koncentracijo dopamina v striatumu kot moški. Večja zaloga dopamina bi morda lahko razložila, zakaj pri ženskah bolezen nastopi kasneje. Zanimivo je, da kljub manjši incidenci in kasnejšemu nastopu bolezni pri ženskah bolezen nato napreduje enako hitro pri obeh spolih 11.
Razlike v klinični sliki so tako na področju motoričnih kot nemotoričnih simptomov in znakov. Tremor naj bi se kot prvi motorični simptom pogosteje pojavljal pri ženskah 11, medtem ko pri moških prevladuje rigidnost 13 14. Pri ženskah so pogostejši depresija, utrujenost, živčnost, občutki žalosti, zaprtje in občutek nemirnih nog 15 16. Po drugi strani so motnja spanja v fazi REM, slinjenje in seksualne motnje značilnejše za moške paciente 17 18. Ženske naj bi po dolgotrajni terapiji z levodopo razvile občutno hujše oblike z levodopo povzročenih diskinezij 15, vendar bi to lahko bila posledica enakega odmerka zdravil kljub v povprečju nižji telesni teži žensk 19. Drugi vzrok bi lahko bil tudi različen metabolizem dopamina glede na spol. Spol namreč znano vpliva na farmakokinetiko in farmakodinamiko dopaminergičnih zdravil 20.
Ker klinične študije namigujejo na zaščitni učinek estradiola v predklinični fazi bolezni oziroma v njeni zgodnji obliki, je vse več študij osredotočenih na hormonski status žensk. Ženske z obojestransko odstranitvijo jajčnikov pred naravnim nastopom menopavze naj bi imele povečano tveganje za nastanek PB 21 22, medtem ko sta večje število rojenih otrok in kasnejši nastop menopavze povezani s kasnejšim nastopom bolezni 11. Z estrogensko nadomestno hormonsko terapijo so skušali tudi vplivati na simptome v zgodnji fazi PB. Dodatek estradiola naj bi ublažil simptome PB v začetni fazi 21 23, prenehanje terapije pa naj bi vodilo v poslabšanje klinične slike 24. Druge študije niso pokazale prepričljivih rezultatov 25 26. Težava prej omenjenih študij je, da so opravljene na majhnem številu pacientov in s kratkim časom izpostavljenosti apliciranim spolnim hormonom.
Podobno kot v kliničnih študijah se tudi na predklinični stopnji nakazuje, da so ženske morda bolj zaščitene ali pa bolje kompenzirajo propad nevronov v začetni fazi bolezni. Raziskave na predklinični ravni so bile narejene na živalskih modelih Parkinsonove bolezni. Najpogostejši izmed njih je t. i. 6-OHDA model PB, kjer dosežemo uničenje nevronov z injiciranjem toksičnega 6-hidroksidopamina (6-OHDA). Ta uniči dopaminske nevrone v SN in s tem zmanjša koncentracijo dopamina v striatumu 27. Gillies s sodelavci je v več študijah na podganjih modelih PB prišla do zaključka, da ob enaki dozi 6-OHDA ta povzroči večjo izgubo dopamina v striatumu pri samcih kot pri samicah 28 29 30. Zanimivo pa so te razlike izražene le do izgube približno 60 % dopaminskih nevronov v SN, pri večjem deležu uničenja nevronov pa razlik v količini dopamina v striatumu med spoloma ni bilo več 29 30 31.
Ali je vzrok spolnim razlikam estradiol, so ugotavljali z izpostavljenostjo različnim ravnem spolnih hormonov. Izguba dopamina pri samicah, ki so pred aplikacijo 6-OHDA prestale še dodatno obojestransko odstranitev jajčnikov, je bila večja kot pri ostalih samicah. Učinek odstranitve jajčnikov oziroma večji upad dopamina so izničili, če so pred aplikacijo prvi skupini samic dodali estradiol 28 32. Izguba dopamina je odvisna tudi od faze menstrualnega ciklusa. 6-OHDA namreč povzroči manjšo izgubo dopamina v striatumu, če ga apliciramo v času proestrusa, ko je raven estradiola najvišja, v primerjavi z diestrusom, ko je raven hormona najnižja 33.
Obratno pa je obojestranska odstranitev testisov pri samcih pred aplikacijo 6-OHDA povzročila manjšo izgubo dopamina v striatumu kot pri ostalih samcih 28. Višja raven testosterona zmanjša količino dopamina šele po tem, ko ga aromataze pretvorijo v estradiol. Učinek estradiola torej ni univerzalen, ampak je njegova zaščitna ali škodljiva vloga odvisna od samega spola 31.
Pričakovali bi, da je vsebnost dopamina v striatumu sorazmerna z izgubo dopaminskih nevronov v SN. Kljub razlikam v koncentraciji dopamina v striatumu niso našli razlik v preživetju dopaminskih nevronov med spoloma 30 34. Možna razlaga je, da samice veliko bolje kompenzirajo izgubo dopaminskih nevronov kot samci. Sposobnost kompenzacije možganov je dobro znana, saj naj bi ravno to pojasnjevalo, zakaj se simptomi PB izrazijo šele ob propadu 60 % dopaminskih nevronov oziroma ko pade raven striatalnega dopamina na 20 % začetne vrednosti 35 36.
Sam mehanizem hormonske zaščite ali kompenzacije še ni razjasnjen. Ena izmed verjetnih hipotez je, da estradiol zniža koncentracijo dopaminskih transporterjev (DAT) v striatumu. To so transporterji, ki so pomembni za privzem in posledično razgradnjo dopamina, pri čemer pa nastajajo škodljivi prosti kisikovi radikali. Preko njih delujejo tudi različni toksini, kamor spada 6-OHDA. Raven DAT je povečana v fazi diestrusa, ko je raven estradiola najnižja in obratno 30. Teorija bi torej lahko pojasnila, zakaj aplikacija toksina povzroči različno zmanjšanje dopamina glede na fazo menstrualnega ciklusa.
Sam estradiol vpliva tudi na metabolizem dopamina. Pri samicah glodavcev endogeni in eksogeni estradiol poveča tako bazalno kot s kalijem in amfetaminom povzročeno izločanje dopamina v striatumu 37 38. Estradiol tudi poveča reciklažo dopamina in je zmožen v ženskem striatumu bolj znižati koncentracijo DAT kot v moškem 30. Estradiol lahko na dopaminergčno os torej vpliva neposredno ali pa posredno preko drugih sistemov. Eden izmed teh je jedro locus coeruleus. Ta vpliva na raven dopamina preko noradrenergičnega sistema 39. Estradiol pri samicah povečuje izražanje encima tirozin hidroksilaze, ki je udeležen pri sintezi tako dopamina kot noradrenalina. Po drugi strani testosteron pri samcih zavira nastanek tega encima, vendar zopet šele potem, ko se ta z aromatazo pretvori v estradiol 40. Slednji podatek je podobna ugotovitev kot pri učinku testosterona na raven striatalnega dopamina pri podganjih samcih.
Prepoznati in ovrednotiti razlike med spoloma pri PB bi bilo koristno tako v klinični oceni in obravnavi bolnika kot pri razumevanju patofizioloških mehanizmov bolezni. Če so razlike med spoloma res povezane z etiologijo, razvojem, prognozo bolezni in/ali z odgovorom na zdravljenje bolezni, potem bi lahko z novim znanjem lažje svetovali pacientom, bolj usmerjeno uporabljali obstoječa zdravila ali razvili personalizirane strategije zdravljenja. Obenem bi morali spol pacientov upoštevati tudi pri bodočih intervencijskih in opazovalnih kliničnih študijah.
-
___
-
http//:www.trepetlika.si pridobljeno 12.12.2017 ↩
-
Jankovic J. Parkinson’s disease: clinical features and diagnosis. Journal of neurology, neurosurgery and psychiatry. 2008; 79(4):368-76. ↩
-
Beitz JM. Parkinson’s disease: a review. Frontiers in bioscience. 2014;6:65-74. ↩
-
Jankovic J, McDermott M, Carter J, Gauthier S, Goetz C, Golbe L, et al. Variable expression of Parkinson’s disease: a base-line analysis of the DATATOP cohort. The Parkinson Study Group. Neurology. 1990;40:1529-34. ↩
-
Foltynie T, Brayne C, Barker RA. The heterogeneity of idiopathic Parkinson’s disease. Journal of neurology. 2002;249:138-45. ↩
-
Gomez Arevalo G, Jorge R, Garcia S, Scipioni O, Gershanik O. Clinical and pharmacological differences in early- versus late-onset Parkinson’s disease. Movement disorders : official journal of the Movement Disorder Society. 1997;12:277-84. ↩
-
Czlonkowska A, Ciesielska A, Gromadzka G, Kurkowska-Jastrzebska I. Gender differences in neurological disease: role of estrogens and cytokines. Endocrine. 2006;29:243-56. ↩
-
Wooten GF, Currie LJ, Bovbjerg VE, Lee JK, Patrie J. Are men at greater risk for Parkinson’s disease than women? Journal of neurology, neurosurgery, and psychiatry. 2004 Apr;75(4):637-9. ↩
-
Fullard MF, Thibault DP, Todaro V, et al. Sex disparities in health and health care utilization after Parkinson diagnosis: Rethinking PD associated disability. Parkinsonism Relat Disord. 2017;(14). ↩
-
Elbaz, A., Bower, J. H., Maraganore, D. M., McDonnell, S. K., Peterson, B. J., Ahlskog, J. E., et al. Risk tables for parkinsonism and Parkinson’s disease. Journal of Clinical Epidemiology, 55(1), 25-31. ↩
-
Haaxma CA, Bastiaan RB, George FB, et al. Gender differences in Parkinson’s disease. Journal of Neurology, Neurosurgery and Psychiatry. 2007;78:819–824 ↩
-
Lyons KE, Hubble JP, Troster AI, Pahwa R, Koller WC. Gender differences in Parkinson’s disease. Clinical neuropharmacology. 1998;21:118-21. ↩
-
Yoritaka A, Ohizumi H, Tanaka S, Hattori N. Parkinson’s disease with and without REM sleep behaviour disorder: are there any clinical differences? European Neurology. 2009; 61(3):164–170. ↩
-
Ozekmekci S, Apaydin H, Kilic E. Clinical features of 35 patients with Parkinson’s disease displaying REM behavior disorder. Clinical Neurology and Neurosurgy. 2005; 107(4):306–309. ↩
-
Martinez-Martin, P, Falup Pecurariu, C, Odin et al. Gender-related differences in the burden of non-motor symptoms in Parkinson’s disease. Neurology. 259; 1639–1647. ↩
-
Liu R, Umbach DM, Peddada SD, Xu Z, Troster AI, Huang X, et al. Potential sex differences in nonmotor symptoms in early drug-naive Parkinson disease. Neurology. 2015;84:2107-15. ↩
-
Miller IN, Cronin-Golomb A. Gender differences in Parkinson’s disease: clinical characteristics and cognition. Movement disorders : official journal of the Movement Disorder Society. 2010;25:2695-703. ↩
-
Picillo M, Amboni M, Erro R, Longo K, Vitale C, Moccia M, et al. Gender differences in non-motor symptoms in early, drug naive Parkinson’s disease. Journal of neurology. 2013;260:2849-55. ↩
-
Zappia M, Crescibene L, Arabia G, et al. Body weight influences pharmacokinetics of levodopa in Parkinson’s disease. Clinical neuropharmacology. 2002; 25(2):79–82. ↩
-
Meibohm B, Beierle I, Derendorf H. How important are gender differences in pharmacokinetics? Clinical Pharmacokinetics. 2002;41(5):329-42. ↩
-
Benedetti MD, Maraganore DM, Bower JH, et al. Hysterectomy, menopause, and estrogen use preceding Parkinson’s disease: an exploratory case-control study. Movement Disordorders. 2001. ↩
-
Ragonese P, D’Amelio M, Salemi G, et al. Risk of Parkinson disease in women: effect of reproductive characteristics. Neurology. 2004;11:2010–14. ↩
-
Saunders-Pullman, R, Gordon-Elliott, J, Parides et al. The effect of estrogen replacement on early Parkinson’s disease. Neurology. 1999; 1417–1421. ↩
-
Sandyk, R, Estrogens and the pathophysiology of Parkinson’s disease. Jornal of Neuroscience. 45: 119–122. ↩
-
Tsang, KL, Ho, SL, Lo, S., Estrogen improves motor disability in parkinsonian postmenopausal women with motor fluctuations. Neurology. 2000; 54: 2292–2298. ↩
-
Parkinson Study Group POETRY Investigators. A randomized pilot trial of estrogen replacement therapy in post-menopausal women with Parkinson’s disease. Parkinsonism Related Disordorders. 2011;17(10):757-60. ↩
-
Ungerstedt U. Postsynaptic supersensitivity after 6-hydroxy-dopamine induced degeneration of the nigro-striatal dopamine system. Acta Physiologica Scandinavia Supplement. 1971;367:69-93. ↩
-
Murray, HE, Pillai, AV, McArthur, SR, Razvi et al. Dose- and sex-dependent effects of the neurotoxin 6- hydroxydopamine on the nigrostriatal dopaminergic pathway of adult rats: differential actions of estrogen in males and females. Neuroscience. 2003;116: 213– 222. ↩
-
Gillies, GE, Murray, HE, Dexter, D, McArthur, S. Sex dimorphisms in the neuroprotective effects of estrogen in an animal model of Parkinson’s disease. Pharmacology and Biochemistry 2004;78: 513–522. ↩
-
McArthur, S, Murray, HE, Dhankot, et al. Striatal susceptibility to a dopaminergic neurotoxin is independent of sex hormone effects on cell survival and DAT expression but is exacerbated by central aromatase inhibition. Journal of Neurochemistry. 2007; 100: 678–692. ↩
-
Gillies, GE, McArthur, S., Independent influences of sex steroids of systemic and central origin in a rat model of Parkinson’s disease: a contribution to sex specific neuroprotection by estrogens. Hormonal Behaviour. 2010; 57: 23–34. ↩
-
Dluzen, D. Estrogen decreases corpus striatal neurotoxicity in response to 6- hydroxydopamine. Brain Research. 1997; 767: 340–344. ↩
-
Dluzen, D, Horstink, M. Estrogen as neuroprotectant of nigrostriatal dopaminergic system: laboratory and clinical studies. Endocrine 2003; 21: 67–75. ↩
-
Moroz, IA, Rajabi, H, Rodaros D, Stewart J. Effects of sex and hormonal status on astrocytic basic fibroblast growth factor-2 and tyrosine hydroxylase immunoreactivity after medial forebrain bundle 6-hydroxydopamine lesions of the midbrain dopamine neurons. Neuroscience. 2003; 118: 463–476. ↩
-
Bezard, E, Gross, CE, Brotchie, JM. Presymptomatic compensation in Parkinson’s disease is not dopamine-mediated. Trends in Neuroscience. 2003; 2: 215–221. ↩
-
Song, DD, Haber, SN, Striatal responses to partial dopaminergic lesion: evidence for compensatory sprouting. Journal of Neuroscience. 2000; 20: 5102–5116. ↩
-
Serova, LI, Maharjan, S, Huang, A et al. Response of tyrosine hydroxylase and GTP cyclohydrolase I gene expression to estrogen in brain catecholaminergic regions varies with mode of administration. Brain Research 2004; 101: 1–8. ↩
-
Dluzen, DE. Unconventional effects of estrogen uncovered. Trends in Pharmacology. 2005; 26485–487. ↩
-
Marien, MR, Colpaert, FC, Rosenquist, AC. Noradrenergic mechanisms in neurodegenerative diseases: a theory. Brain Research. 2004; 45: 38–78. ↩
-
Thanky, NR, Son, JH, Herbison, AE. Sex differences in the regulation of tyrosine hydroxylase gene transcription by estrogen in the locus coeruleus of TH9-LacZ transgenic mice. Molecular Brain Research 2004; 10: 220–226. ↩
Kaja Kolmančič, dr.med.,
Laboratorij za raziskave možganov,
Inštitut za patološko fiziologijo,
Medicinska fakulteta v Ljubljani.
Recenzija:
doc. dr. Maja Kojović, dr. med, specialistka nevrologije
Klinični oddelek za bolezni živčevja,
Nevrološka klinika, UKC Ljubljana
Objavljeno januarja 2018.