Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Difuzijsko magnetnoresonančno slikanje
Orodje za oceno mikro- in makrostrukture možganov
članki
eSinapsa, 2011-1
Zvezdan Pirtošek
Eksoskeleti – inteligentne bionske naprave
Marko Munih
O aktualnih dilemah draženja globokih možganskih struktur pri obsesivno - kompulzivni motnji
Nadja Jarc
Sledite svojo srečo ... z iPhone
Urban Kordeš
eSinapsa, 2011-2
Renata Salecl
Gašper Tkačik
Astrociti – spregledane zvezde nevrobiologije
Marko Kreft, Robert Zorec
Sašo Dolenc
Meditacija - malo truda, veliko koristi
Luka Dimic
eSinapsa, 2011-3
Mara Bresjanac
Martina Starc
Rok Berlot
Varnost uporabe generičnih protiepileptičnih zdravil
Mojca Kržan, Matevž Kržan
Možgani, računalniki - nekaj vmes
Miha Pelko
eSinapsa, 2012-4
Ali so moški in ženski možgani različni?
Gregor Majdič
O kognitivnih motnjah pri bolnikih s Parkinsonovo boleznijo
Dejan Georgiev
Akutno možgansko kap lahko uspešno zdravimo
Nina Vujasinovič, Bojana Žvan
Vloga nevropsihološke diagnostike pri odkrivanju zgodnjih znakov alzheimerjeve bolezni
Simon Brezovar
eSinapsa, 2013-5
Učinek placeba brez lažnih zdravil in zavajanja
Mara Bresjanac
Subarahnoidna krvavitev zaradi tromboze venskih sinusov
Mateja Repar, Anita Resman Gašperčič
Srečanje dveh velikanov: možganov in imunskega sistema
Matej Markota
Novo odkritje na področju sporadičnih prionskih bolezni
Jana Jerše, Nadja Jarc
eSinapsa, 2013-6
Odstranjevanje možganskih tumorjev pri budnem bolniku
Andrej Vranič, Jasmina Markovič, Blaž Koritnik
Zmedena bolnica, ki nič ne vidi ali PRES
Manja Hribar, Vid Zgonc
Manja Hribar
Sistemska skleroza in ishemična možganska kap - vzročna povezanost ali le koincidenca?
Mateja Repar, Janja Pretnar Oblak
Netravmatska lokalizirana konveksitetna subarahnoidna krvavitev
Mateja Repar, Fajko F. Bajrović
Klemen Grabljevec
Z omejevanjem spodbujajoča terapija pri bolnikih po nezgodni možganski poškodbi
Dejana Zajc, Klemen Grabljevec
eSinapsa, 2014-7
Možgani v mreži navezanosti, ki nas zaznamuje
Barbara Horvat
Vpliv senzoričnega dotoka na uglasitev možganskih povezav
Peter Gradišnik
Človeški konektom ali kakšne so zveze v naših možganih
Blaž Koritnik
Niko Lah
Torkove delavnice za osnovnošolce
Mateja Drolec Novak, Vid V. Vodušek
Da ne pozabim! Tehnike za pomladitev spomina
Klara Tostovršnik, Hana Hawlina
Površina socialne nevroznanosti
Manuel Kuran
Clarity - bistri možgani Karla Deisserotha
Gregor Belušič
Barbara Gnidovec Stražišar
Bojana Žvan
Nevroplastičnost po možganski kapi
Marjan Zaletel
Klinično psihološka obravnava pacientov po možganski kapi in podpora pri vračanju na delovno mesto
Barbara Starovasnik Žagavec
Možgani: organ, s katerim ljubimo
Andraž Matkovič
Marija Šoštarič Podlesnik
Gibalno-kognitivna vadba: praktična delavnica
Mitja Gerževič, Marina Dobnik
Anton Grad
Nevrologija, imunologija, psihiatrija …
Bojan Rojc
Andraž Stožer, Janez Bregant
Dominika Novak Pihler
Možganska kap – »kako ostati v omrežju?«
Nina Ozimic
Klara Tostovršnik
eSinapsa, 2014-8
Znotrajžilno zdravljenje možganskih anevrizem
Tamara Gorjanc, Dimitrij Lovrič
Obravnava hladnih možganskih anevrizem
Bojana Žvan, Janja Pretnar Oblak
Ali deklice z Rettovim sindromom govorijo z očmi?
Anka Slana, Urška Slana
Progresivna multifokalna encefalopatija
Urša Zabret, Katarina Šurlan Popovič
Ne ubijaj – poskusi na živalih
Martina Perše
Poizkusi na živalih - za in proti
Simon Horvat
eSinapsa, 2015-9
Kako deluje navigacijski sistem v naših možganih
Simon Brezovar
Vsakodnevno delo slepe osebe / s slepo osebo
Denis Kamnar
Uroš Marušič
Manca Tekavčič Pompe
Toni Pustovrh
Marko Hawlina
Od svetlobe do podobe ali kako vidijo svet naši možgani
Simon Brezovar
Janja Hrastovšek
Zala Kurinčič
Pogledi na mejno osebnostno motnjo
Jerica Radež, Peter Kapš
Uvid kot socialno psihološki fenomen
Vid Vodušek
Uvod v vidno-prostorske funkcije s praktičnimi primeri
Ana Bujišić, Sanja Roškar
eSinapsa, 2015-10
Difuzijsko magnetnoresonančno slikanje
Rok Berlot
Katja Pavšič
Radiološko izolirani sindrom - ali ga moramo poznati?
Matej Vouk, Katarina Šurlan Popovič
Kako izgledajo možgani, ki govorijo več jezikov?
Gašper Zupan
Nov pristop v rehabilitaciji - terapija s pomočjo psa
Mateja Drljepan
Pogled v maternico z magnetnoresonančno preiskavo
Taja Jordan, Tina Vipotnik Vesnaver
Saša Zorjan
Saša Zorjan
Nevroestetika: ko nevroznanost obišče galerijo
Anja Voljavec, Hana Hawlina, Nika Vrabič
Ali so psihogeni neepileptični napadi res psihogeni?
Saška Vipotnik, Gal Granda
Kako nam lahko glasna glasba »vzame« sluh in povzroči tinitus
Nejc Steiner, Saba Battelino
eSinapsa, 2016-11
Mara Bresjanac
Kako ultrazvok odpira pot v možgane
Kaja Kolmančič
Kako je epigenetika spremenila nevroznanost
Metka Ravnik Glavač
Ondinino prekletstvo ali sindrom prirojene centralne hipoventilacije
Katja Pavšič, Barbara Gnidovec Stražišar, Janja Pretnar Oblak, Fajko F. Bajrović
Zika virus in magnetnoresonančna diagnostika nepravilnosti osrednjega živčevja pri plodu
Rok Banko, Tina Vipotnik Vesnaver
Motnje ravnotežja otrok in odraslih
Nejc Steiner, Saba Battelino
eSinapsa, 2016-12
Vloga magnetnoresonančne spektroskopije pri obravnavi možganskih tumorjev
Gašper Zupan, Katarina Šurlan Popovič
Tiskanje tridimenzionalnih modelov v medicini
Andrej Vovk
Aleš Oblak
Kevin Klarič
Sinestezija: umetnica, ki ne želi odrasti
Tisa Frelih
Računska psihiatrija: od nevroznanosti do klinike
Nastja Tomat
Kognitivni nadzor: od vsakdanjega življenja do bolezni
Vida Ana Politakis
eSinapsa, 2017-13
Internet: nadgradnja ali nadomestek uma?
Matej Perovnik
Vloga črevesnega mikrobioma pri odzivu na stres
Vesna van Midden
Stres pušča posledice tako na človeškem kot živalskem organizmu
Jasmina Kerčmar
Prikaz normalne anatomije in bolezenskih stanj obraznega živca z magnetno resonanco
Rok Banko, Matej Vrabec
Psihedelična izkušnja in njen zdravilni potencial
Anja Cehnar, Jona Basle
Vpliv hiperglikemije na delovanje možganov
Jasna Šuput Omladič, Simona Klemenčič
Nevrofibromatoza: napredujoče obolenje centralnega in perifernega živčevja
Nejc Steiner, Saba Battelino
Fenomen žrtvenega jagnja v dobi interneta
Dolores Trol
Tesnoba staršev in strategije spoprijemanja, ko pri otroku na novo odkrijejo epilepsijo
Daša Kocjančič, Petra Lešnik Musek, Vesna Krkoč, David Gosar
eSinapsa, 2017-14
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
eSinapsa, 2018-15
Susceptibilno poudarjeno magnetnoresonančno slikanje pri bolniku z ALS
Alja Vičič, Jernej Avsenik, Rok Berlot
Sara Fabjan
Reverzibilni cerebralni vazokonstrikcijski sindrom – pot do diagnoze
Maja Cimperšek, Katarina Šurlan Popovič
Liam Korošec Hudnik
Kognitivno funkcioniranje pri izgorelosti
Marina Horvat
eSinapsa, 2019-16
Maša Čater
Saša Koprivec
Infekcije osrednjega živčnega sistema s flavivirusi
Maja Potokar
Raziskava: Kako depresija vpliva na kognitivne sposobnosti?
Vida Ana Politakis
Razvoj depresije pri otrocih z vidika navezovalnega vedenja
Neža Grgurevič
Sonja Prpar Mihevc
Umetno inteligentna nevroznanost: srečanje nevronskih mrež in možganske fiziologije
Kristijan Armeni
Čebelji strup pri preventivi nevrodegenerativnih bolezni in priložnost za klinično prakso
Matjaž Deželak
eSinapsa, 2019-17
IgG4+ – skupni imenovalec diagnoz iz preteklosti
Cene Jerele, Katarina Šurlan Popovič
Nov molekulski mehanizem delovanja ketamina v astrocitih
Matjaž Stenovec
Praktični pristop k obravnavi utrujenosti in motenj spanja pri bolnikih z multiplo sklerozo
Nik Krajnc, Leja Dolenc Grošelj
Jure Pešak
eSinapsa, 2020-18
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
eSinapsa, 2020-19
Ob mednarodnem dnevu znakovnih jezikov
Anka Slana Ozimič
Teorija obetov: kako sprejemamo tvegane odločitve
Nastja Tomat
Sara Fabjan
Matjaž Deželak
Nina Stanojević, Uroš Kovačič
Od človeških nevronov do možganskih organoidov – nova obzorja v nevroznanosti
Vesna M. van Midden
Splošna umetna inteligenca ali statistične jezikovne papige?
Kristijan Armeni
Zunajcelični vezikli kot prenašalci zdravilnih učinkovin preko krvno-možganske prepreke
Saša Koprivec
Matjaž Deželak
eSinapsa, 2021-20
Migrena: starodavna bolezen, sodobni pristopi k zdravljenju
Eva Koban, Lina Savšek
Zgodnji razvoj socialnega vedenja
Vesna Jug
Nastja Tomat
Mikrosplet: povezovanje preko mikrobioma
Tina Tinkara Peternelj
Stimulacija možganov kot način zdravljenja depresije
Saša Kocijančič Azzaoui
eSinapsa, 2021-21
eSinapsa, 2022-22
Sodobni vidiki motenj hranjenja
Karin Sernec
Ples in gibalni dialog z malčki
Neva Kralj
Atul Gawande
Jezikovna funkcija pri Alzheimerjevi bolezni
Gašper Tonin
Dostava terapevtikov preko krvno-možganske pregrade
Matjaž Deželak
eSinapsa, 2022-23
Akutni ishemični infarkt hrbtenjače pri zdravih otrocih – kaj lahko pove radiolog?
Katarina Šurlan Popovič, Barbara Šijaković
eSinapsa, 2023-24
Možganska omrežja pri nevrodegenerativnih boleznih
Tomaž Rus, Matej Perovnik
Morske živali kot navdih za nevroznanstvenike: morski konjiček, morski zajček in klobučnjak
Tina Bregant
Metoda Feldenkrais: gibanje in nevroplastičnost
Mateja Pate
Etično naravnana animalna nevroznanost
Maša Čater
Helena Motaln, Boris Rogelj
eSinapsa, 2023-25
Urban Košak, Damijan Knez, Anže Meden, Simon Žakelj, Jurij Trontelj, Jure Stojan, Maja Zakošek Pipan, Kinga Sałat idr.
eSinapsa, 2024-26
Naravno okolje kot vir zdravja in blagostanja
Karin Križman, Grega Repovš, Gaja Zager Kocjan, Gregor Geršak
Katja Peganc Nunčič, Damjan Osredkar
Tanja Goltnik
Ali je zgodnje vstajanje dedno?
Cene Skubic, Laura Plavc, Damjana Rozman, Leja Dolenc Grošelj
eSinapsa, 2024-27
Širša terapevtska uporaba ketamina: potenciali in izzivi
Kristian Elersič
Moč vpliva socialne opore na bolečino
Jana Verdnik
Benjamin Bušelič
Urška Černe, Anemari Horvat, Robert Zorec, Nina Vardjan
eSinapsa, 2025-28
Maša Čater, Nastja Blagovič, Urška Jerič, Agata Kokalj Malovrh, Nuša Balen, Tanja Kunej
Vpliv izobrazbe na skrb za zdravje možganov
Hana Kos, Matej Perovnik
Selena Horvat, Anja Pišlar
Ko je Robert Brown pod mikroskopom opazoval nenehno gibanje delcev peloda v kapljici vode, je bil sprva prepričan, da opazuje “silo življenja”, zaradi katere se ples delcev ne ustavi. Skoraj dve stoletji kasneje nevroznanstveniki na podlagi termičnega oziroma Brownovega gibanja molekul vode proučujemo strukturo in delovanje človeških možganov.
 Nevroanatomi so bili že v 19. stoletju prepričani, da je za delovanje možganov bistveno povezovanje informacij iz različnih predelov, pri čemer imajo ključno vlogo asociacijske povezave vlaken bele možganovine (BM)1. Pri proučevanju arhitekture BM so bili znanstveniki dolgo omejeni na patološke sekcije ter invazivne metode vbrizgavanja sledil aksonov v živalske možgane. Razmah difuzijskega magnetnoresonančnega (MR) slikanja, na osnovi katerega za sklepanje o usmerjenosti živčnih vlaken izkoriščamo termično gibanje molekul vode, je omogočil neinvazivno proučevanje strukture možganov živih preiskovancev.
Nevroanatomi so bili že v 19. stoletju prepričani, da je za delovanje možganov bistveno povezovanje informacij iz različnih predelov, pri čemer imajo ključno vlogo asociacijske povezave vlaken bele možganovine (BM)1. Pri proučevanju arhitekture BM so bili znanstveniki dolgo omejeni na patološke sekcije ter invazivne metode vbrizgavanja sledil aksonov v živalske možgane. Razmah difuzijskega magnetnoresonančnega (MR) slikanja, na osnovi katerega za sklepanje o usmerjenosti živčnih vlaken izkoriščamo termično gibanje molekul vode, je omogočil neinvazivno proučevanje strukture možganov živih preiskovancev.
Z nekritičnim povzemanjem izsledkov raziskav se tudi v nevroznanstveni srenji pojavljajo nejasnosti o zmožnostih in omejitvah nove metode. V pričujočem pregledu predstavljamo ozadje novejše raziskovalne tehnike ter v obdobju, ko je proučevanje človeškega konektoma iz strokovnih člankov že prestopilo v okvir poljudnega znanstvenega branja, opozarjamo na nekatere njene omejitve.
Difuzija molekul vode kot odraz mikrostrukture tkiva
Molekule vode se v raztopinah nenehno naključno gibljejo, odmik posamezne molekule od začetnega položaja pa je odvisen od časa opazovanja in difuzijskega koeficienta. V človeškem telesu pri relativno stalni telesni temperaturi slednjega določajo strukture, ki omejujejo difuzijo. V največji meri so to celične membrane2.
Z uporabo dveh nasprotno usmerjenih gradientnih pulzov enake velikosti napravimo MR signal občutljiv na difuzijo molekul vode3. Gibanje slednjih v času med obema pulzoma vodi v izgubo signala. Omejitev difuzije se tako odraža v višji jakosti signala. To ugotovitev s pridom izkoriščamo tudi klinično, naprimer pri akutni možganski kapi, pri kateri pride do celičnega edema, zmanjšane difuzivnosti in posledično do spremembe difuzijsko obteženega signala že nekaj minut po nastopu simptomov, še preden lahko okvarjeno področje prikažemo z uporabo drugih slikovnih tehnik4.
Kadar skušamo opisati urejenost tkiv, kot v primeru vlaken BM, nam zgolj informacija o celokupni difuzivnosti ne zadošča. Pomagamo si s konceptom difuzijskega tenzorja – matriko, s katero opišemo difuzijo molekul vode v vseh smereh prostora za vsak posamezni voksel, to je najmanjšo prostorninsko enoto, ki jo lahko prikažemo glede na ločljivost uporabljene slikovne tehnike. Difuzijski tenzor si lahko predstavljamo kot elipsoid, pri katerem podaljšana os kaže prevladujočo smer difuzije molekul vode.
Tovrstno MR slikanje imenujemo slikanje difuzijskih tenzorjev (angl. diffusion tensor imaging, DTI). Če predhodno opisane gradiente usmerimo v različne smeri v prostoru, pridobimo informacijo o difuziji molekul vode v posamezni smeri, z analizo zajetega signala pa lahko v vsakem vokslu rekonstruiramo difuzijski tenzor in tako sklepamo o usmerjenosti vlaken BM. Difuzija je izotropna, kadar je enakomerna v vse smeri, ali pa anizotropna, kadar je difuzija v določene smeri bolj oziroma manj omejena. V BM je difuzija bolj omejena v smeri prečno na aksone kot vzdolž njih, kar s pridom izkoriščamo za prikaz strukture tkiva.
Na podlagi zajetega signala lahko izračunamo različne kazalce mikrostrukturne organiziranosti možganskega tkiva. Med drugimi so to srednja difuzivnost (MD, angl. mean diffusivity), ki kaže na celokupno difuzivnost v posameznem vokslu ne glede na usmerjenost difuzije ter od usmerjenosti difuzije odvisni aksialna (AD) in radialna difuzivnost (RD), ki ocenjujeta količino difuzije vzdolž oziroma prečno na najdaljšo os elipsoida. Pogosto uporabljamo tudi mero frakcijske anizotropije (FA, angl. fractional anisotropy), ki ocenjuje razmerje med prevladujočo usmerjenostjo difuzije in velikostjo celokupne difuzije. Indeks FA se giblje med vrednostma 0, ko je difuzija izotropna in 1, ko je usmerjena izključno vzdolž ene osi (Slika 1a).
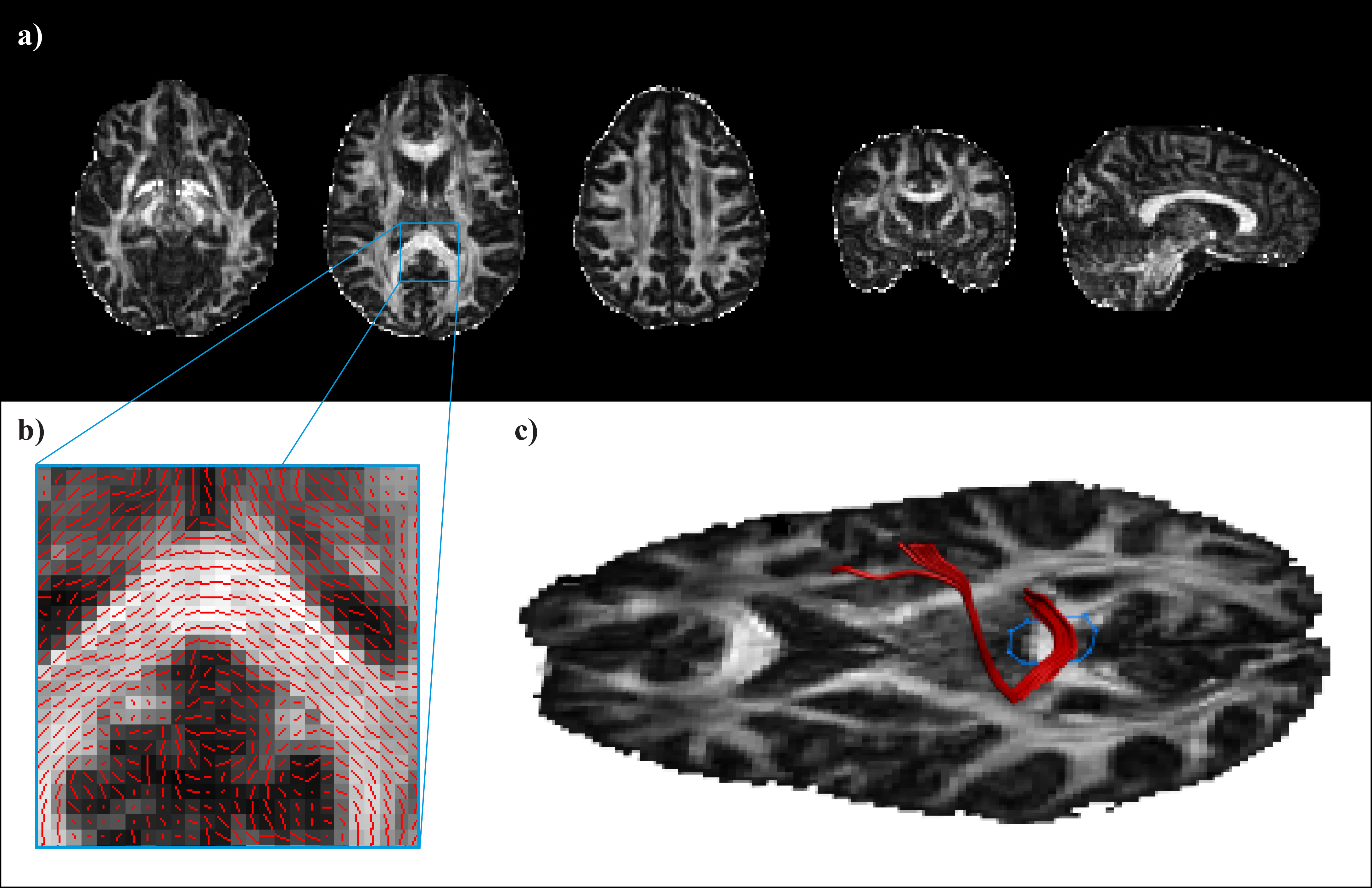
Slika 1. a) Mape frakcijske anizotropije (FA) v človeških možganih. Intenziteta posameznega voksla je premosorazmerna vrednosti FA v razponu med 0 (povsem enakomerna difuzija molekul vode v vse smeri) in 1 (difuzija zgolj vzdolž ene osi). b) Prevladujoča usmerjenost difuzijskega tenzorja v posameznih vokslih. c) Primer deterministične traktografije.
Pasti interpretacije kazalcev mikrostrukture
Kazalci DTI se spreminjajo tako z zdravim staranjem kot pri bolezenskih stanjih. Velja, da se s staranjem in pri nevrodegenerativnih obolenjih zaradi celičnih okvar zmanjša usmerjenost difuzije in poveča celokupna difuzija, kar se odraža v znižani FA in zvišani MD. Izguba mielina pri demielinizacijskih boleznih poveča obseg difuzije prečno na usmerjenost vlaken, tako se zviša RD. Nasprotno, se spremembe AD najpogosteje interpretirajo kot odraz okvare aksonov. Opisane kazalce lahko v vsakem vokslu, v posameznih strukturah BM, ali pa kot povprečne vrednosti večjih predelov, primerjamo med skupinami preiskovancev ali pa proučujemo njihovo povezanost z vedenjskimi in drugimi spremenljivkami. Na ta način lahko sklepamo o vlogi BM v zdravih, starajočih se ali bolezensko spremenjenih možganih5.
Vendarle pa pri sklepanju o integriteti možganskega tkiva preprosti zaključki zaradi omejitev metode največkrat niso mogoči. Velik problem predstavlja omejena ločljivost, ki pri novejših študijah in vivo dosega okoli 2 mm. Tako signal iz vsakega voksla predstavlja povpreček različnih vplivov. V vokslu so pogosto prisotne populacije različno usmerjenih vlaken BM, ki jih brez uporabe kompleksnejših matematičnih metod analize signala ne moremo razločevati med sabo. Do križanj vlaken prihaja približno pri tretjini vokslov BM6. V predelih, kjer je križanje pravokotno, difuzija molekul vode torej poteka v dveh prevladujočih smereh. V tem primeru z uporabo modela difuzijskega tenzorja zaključimo, da je difuzija izotropna, FA pa v visoko organizirani strukturi posledično ocenimo kot nizko. Če bolezenski proces prizadene zgolj eno od obeh križajočih se populacij vlaken, bo difuzija v tem vokslu anizotropna, vrednost FA pa bo višja. Jasno je torej, da spremembe vrednosti FA in tudi drugih kazalcev DTI ne odražajo nujno sprememb integritete tkiva; zaradi zapletene arhitekture vlaken na nivoju posameznih vokslov moramo biti pri tovrstnem sklepanju previdni.
V posameznem vokslu so lahko poleg BM zajete tudi druge strukture, naprimer siva možganovina ali likvor. V njih so vlakna odsotna ali pa niso usmerjena v določeno smer, zaradi česar pride v teh vokslih do znižanja FA in zvišanja MD, kar pa ni posledica mikrostrukturne okvare BM7.
Traktografija – prikaz možganskih povezav
Difuzijski signal izkoriščamo tudi za proučevanje anatomije možganskih povezav. Posamezne trakte BM lahko rekonstruiramo s pomočjo deterministične traktografije (Slika 1b in c). V posameznem vokslu ocenimo prevladujočo smer difuzije vode in navidezni poti molekul sledimo v sosednje voksle. Pri tem temeljimo na predpostavki, da smer z najvišjo difuzivnostjo ustreza usmerjenosti vlaken BM v vokslu. S sledenjem prekinemo, ko dosežemo področje, pri katerem nismo prepričani o usmerjenosti vlaken (tj. nizka vrednost FA) ali pa kadar je med dvema korakoma poti oster kot, ki ni združljiv z anatomijo vlaken. S poznavanjem anatomije in označevanjem področij, ki jih določena struktura mora ali ne sme prečkati, pridobimo tridimenzionalne prikaze struktur BM.
Čeprav s to metodo prikažemo anatomske strukture, njeno slabost predstavlja velika odvisnost od preiskovalca. Zvest prikaz omejujejo tudi šum signala, zajeti artefakti in križanja vlaken, ki jih z uporabo DTI ne moremo razrešiti. Manjka tudi ocena verjetnosti, ki jo lahko pripišemo točnosti rekonstrukcije trakta8. Zaradi tega se lahko poslužujemo probabilistične traktografije, s katero v zajetih slikovnih podatkih ocenimo verjetnost obstoja poti med dvema točkama9.
Konektom
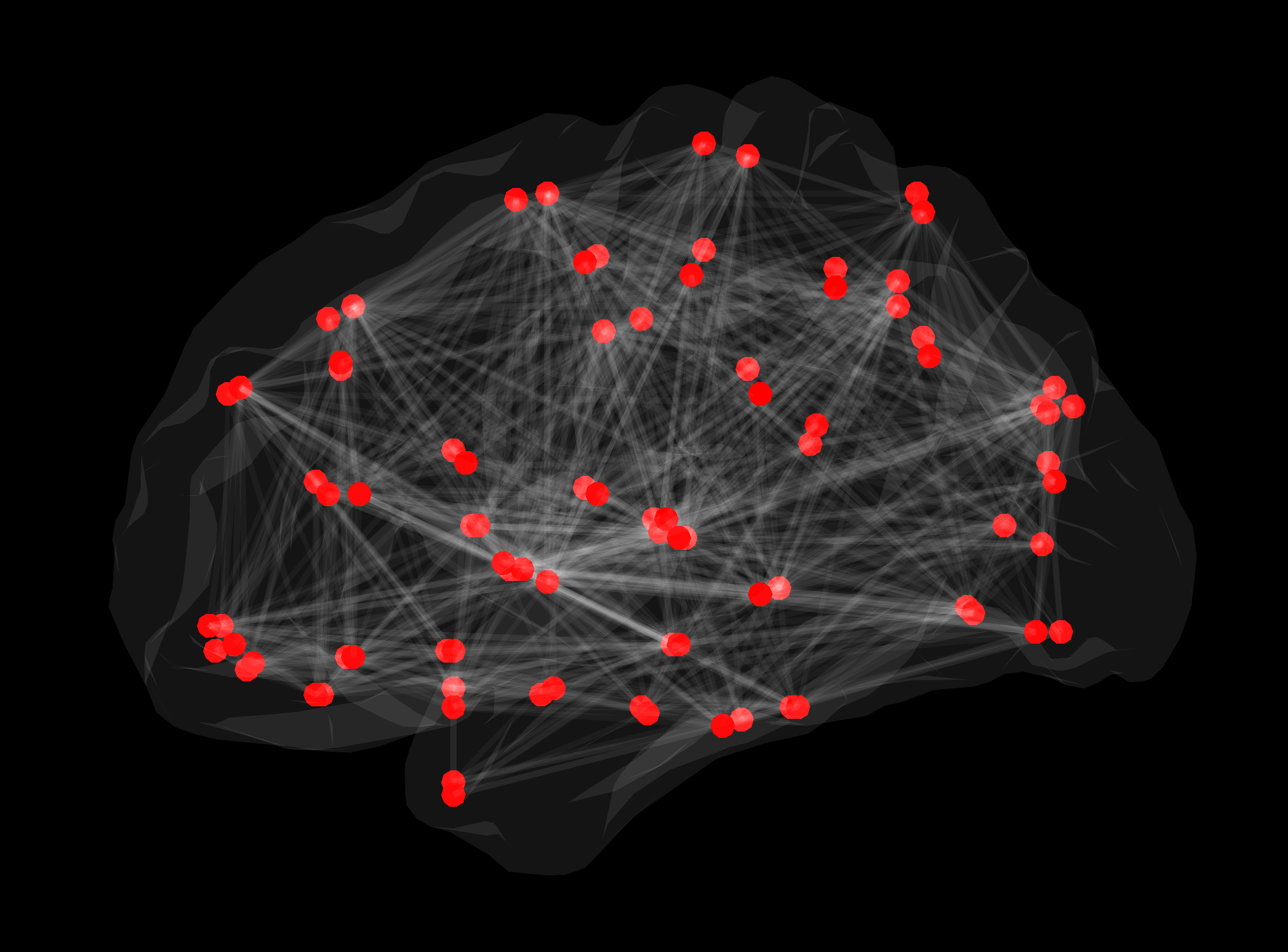
Slika 2. Strukturno omrežje bele možganovine. Rdeče točke predstavljajo posamezne možganske predele, med katerimi so bile z uporabo deterministične traktografije konstruirane posamezne povezave.
Povezave med stotimi milijardami nevronov v možganih človeka tvorijo strukturno omrežje oziroma konektom, ki omogoča hitro in vzporedno procesiranje množice podatkov.
Eden od temeljnih principov organizacije konektoma je fenomen »majhnega sveta«, poznan tudi iz družabnih stikov, povezav med letališči in iz drugih omrežij. Podobno kot v oddaljen manjši kraj letimo s prestopanjem na večjih letališčih, topologija povezav v možganskih omrežjih omogoča, da informacija med dvema oddaljenima predeloma v možganih potuje le z nekaj vmesnimi koraki preko predelov, ki so specializirani za komuniciranje z oddaljenimi predeli. Možgani torej delujejo ekonomično – informacije potujejo hitro tudi med področji, ki med sabo niso neposredno povezana, kar je ugodno tako z energijskega vidika kot glede na potrebno količino celičnih gradnikov10. Novejši izsledki kažejo, da pri številnih boleznih možganov prihaja do sprememb topologije omrežja11. Prav metoda difuzijskega MR slikanja omogoča prikaz zgradbe možganskih omrežij in proučevanje pomena njihovega spreminjanja pri zdravih preiskovancih in pri bolnikih.
Kaj nas čaka v prihodnosti?
Z višjo ločljivostjo slikanja in uporabo naprednejših modelov rekonstrukcije signala bomo pridobili dodaten uvid v mikro in makrostrukturo BM. Projekt Človeški konektom prinaša še dodatne tehnološke izboljšave, od njega in podobnih velikih raziskav pa si obetamo nove uvide v zgradbo in delovanje zdravih ter bolnih možganov 12. Po drugi strani pa se pojavljajo novi metodološki preboji, kot je recimo možnost funkcijskega slikanja z uporabo difuzijskega signala13. Difuzijsko MR slikanje je torej postalo eno temeljnih orodij za proučevanje možganov, »sila življenja« Roberta Browna pa za številne nevroznanstvenike še vedno ostaja izziv.
MR slike so bile posnete v sklopu projekta L3-4255, finančno podprtega s strani Javne agencije za raziskovalno dejavnost Republike Slovenije. Obdelal in pripravil jih je avtor prispevka.
-
___
-
Meynert T. A clinical treatise on diseases of the fore-brain based upon a study of its structure, functions and nutrition. 1885. G.P.Putnam’s Sons, New York. ↩
-
Beaulieu C, Allen PS. Determinants of anisotropic water diffusion in nerves. Magn Reson Med. 1994;31:394-400. ↩
-
Stejskal EO, Tanner JE. Spin diffusion measurements: spin echoes in the presence of a time-dependent field gradient. J Chem Phys. 1965;42:288-292. ↩
-
Hjort N, Christensen S, Solling C, Ashkanian M, Wu O, Rohl L, et al. Ischemic injury detected by diffusion imaging 11 minutes after stroke. Ann Neurol. 2005 Sep;58:462-465. ↩
-
Cercignani M. Strategies for patient-control comparison of diffusion MRI data. In: Jones DK, ed. Diffusion MRI: theory, methods, and applications. New York: Oxford University Press; 2011. p. 485-499. ↩
-
Behrens TEJ, Johansen Berg H, Jbabdi S, Rushworth MFS, Woolrich MW. Probabilistic diffusion tractography with multiple fiber orientations: what can we gain? Neuroimage. 2007 Jan 1;34:144-155. ↩
-
Berlot R, Metzler-Baddeley C, Jones DK, O’Sullivan MJ. CSF contamination contributes to apparent microstructural alterations in mild cognitive impairment. Neuroimage. 2014 May 15;92:27-35. ↩
-
Jones DK. Studying connection in the living human brain with diffusion MRI. Cortex. 2008 Sep;44:936-952. ↩
-
Morris DM, Embleton KV, Parker JM. Probabilistic fibre tracking: differentiation of connections from chance events. Neuroimage. 2008 Oct 1;42:1329-1339. ↩
-
Bullmore E, Sporns O. The economy of brain network organization. Nat Rev Neurosci. 2012 Apr 13;13:336-349. ↩
-
Griffa A, Baumann PS, Thiran JP, Hagmann P. Structural connectomics in brain diseases. Neuroimage. 2013 Oct 15;80:515-526. ↩
-
Koritnik B. Človeški konektom ali kakšne so zveze v naših možganih. eSinapsa. 2014;4. Dosegljivo na: http://www.sinapsa.org/eSinapsa/clanki/88/Človeški konektom ali kakšne so zveze v naših možganih (4.8.2014) ↩
-
Le Bihan D, Urayama S, Aso T, Hanakawa T, Fukuyama H. Direct and fast detection of neuronal activation in the human brain with diffusion MRI. Proc Natl Acad Sci. 2006 May 23;103(21):8263-8268. ↩
Rok Berlot, dr. med.
Nevrološka klinika,
Univerzitetni klinični center Ljubljana
Recenziral
doc. dr. Blaž Koritnik, dr. med.
Nevrološka klinika, Univerzitetni klinični center Ljubljana
Katedra za nevrologijo, Medicinska fakulteta, Univerza v Ljubljani
Prispelo: avgust 2014
Sprejeto: avgust 2014
Objavljeno: november 2015