Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Možgani pod stresom: od celic do duševnih motenj
članki
eSinapsa, 2011-1
Zvezdan Pirtošek
Eksoskeleti – inteligentne bionske naprave
Marko Munih
O aktualnih dilemah draženja globokih možganskih struktur pri obsesivno - kompulzivni motnji
Nadja Jarc
Sledite svojo srečo ... z iPhone
Urban Kordeš
eSinapsa, 2011-2
Renata Salecl
Gašper Tkačik
Astrociti – spregledane zvezde nevrobiologije
Marko Kreft, Robert Zorec
Sašo Dolenc
Meditacija - malo truda, veliko koristi
Luka Dimic
eSinapsa, 2011-3
Mara Bresjanac
Martina Starc
Rok Berlot
Varnost uporabe generičnih protiepileptičnih zdravil
Mojca Kržan, Matevž Kržan
Možgani, računalniki - nekaj vmes
Miha Pelko
eSinapsa, 2012-4
Ali so moški in ženski možgani različni?
Gregor Majdič
O kognitivnih motnjah pri bolnikih s Parkinsonovo boleznijo
Dejan Georgiev
Akutno možgansko kap lahko uspešno zdravimo
Nina Vujasinovič, Bojana Žvan
Vloga nevropsihološke diagnostike pri odkrivanju zgodnjih znakov alzheimerjeve bolezni
Simon Brezovar
eSinapsa, 2013-5
Subarahnoidna krvavitev zaradi tromboze venskih sinusov
Mateja Repar, Anita Resman Gašperčič
Srečanje dveh velikanov: možganov in imunskega sistema
Matej Markota
Novo odkritje na področju sporadičnih prionskih bolezni
Jana Jerše, Nadja Jarc
Učinek placeba brez lažnih zdravil in zavajanja
Mara Bresjanac
eSinapsa, 2013-6
Odstranjevanje možganskih tumorjev pri budnem bolniku
Andrej Vranič, Jasmina Markovič, Blaž Koritnik
Zmedena bolnica, ki nič ne vidi ali PRES
Manja Hribar, Vid Zgonc
Manja Hribar
Sistemska skleroza in ishemična možganska kap - vzročna povezanost ali le koincidenca?
Mateja Repar, Janja Pretnar Oblak
Netravmatska lokalizirana konveksitetna subarahnoidna krvavitev
Mateja Repar, Fajko F. Bajrović
Klemen Grabljevec
Z omejevanjem spodbujajoča terapija pri bolnikih po nezgodni možganski poškodbi
Dejana Zajc, Klemen Grabljevec
eSinapsa, 2014-7
Možgani v mreži navezanosti, ki nas zaznamuje
Barbara Horvat
Vpliv senzoričnega dotoka na uglasitev možganskih povezav
Peter Gradišnik
Človeški konektom ali kakšne so zveze v naših možganih
Blaž Koritnik
Niko Lah
Torkove delavnice za osnovnošolce
Mateja Drolec Novak, Vid V. Vodušek
Da ne pozabim! Tehnike za pomladitev spomina
Klara Tostovršnik, Hana Hawlina
Površina socialne nevroznanosti
Manuel Kuran
Clarity - bistri možgani Karla Deisserotha
Gregor Belušič
Barbara Gnidovec Stražišar
Bojana Žvan
Nevroplastičnost po možganski kapi
Marjan Zaletel
Klinično psihološka obravnava pacientov po možganski kapi in podpora pri vračanju na delovno mesto
Barbara Starovasnik Žagavec
Možgani: organ, s katerim ljubimo
Andraž Matkovič
Marija Šoštarič Podlesnik
Gibalno-kognitivna vadba: praktična delavnica
Mitja Gerževič, Marina Dobnik
Anton Grad
Nevrologija, imunologija, psihiatrija …
Bojan Rojc
Andraž Stožer, Janez Bregant
Dominika Novak Pihler
Možganska kap – »kako ostati v omrežju?«
Nina Ozimic
Klara Tostovršnik
eSinapsa, 2014-8
Znotrajžilno zdravljenje možganskih anevrizem
Tamara Gorjanc, Dimitrij Lovrič
Obravnava hladnih možganskih anevrizem
Bojana Žvan, Janja Pretnar Oblak
Ali deklice z Rettovim sindromom govorijo z očmi?
Anka Slana, Urška Slana
Progresivna multifokalna encefalopatija
Urša Zabret, Katarina Šurlan Popovič
Ne ubijaj – poskusi na živalih
Martina Perše
Poizkusi na živalih - za in proti
Simon Horvat
eSinapsa, 2015-9
Kako deluje navigacijski sistem v naših možganih
Simon Brezovar
Vsakodnevno delo slepe osebe / s slepo osebo
Denis Kamnar
Uroš Marušič
Manca Tekavčič Pompe
Toni Pustovrh
Marko Hawlina
Od svetlobe do podobe ali kako vidijo svet naši možgani
Simon Brezovar
Janja Hrastovšek
Zala Kurinčič
Pogledi na mejno osebnostno motnjo
Jerica Radež, Peter Kapš
Uvid kot socialno psihološki fenomen
Vid Vodušek
Uvod v vidno-prostorske funkcije s praktičnimi primeri
Ana Bujišić, Sanja Roškar
eSinapsa, 2015-10
Difuzijsko magnetnoresonančno slikanje
Rok Berlot
Katja Pavšič
Radiološko izolirani sindrom - ali ga moramo poznati?
Matej Vouk, Katarina Šurlan Popovič
Kako izgledajo možgani, ki govorijo več jezikov?
Gašper Zupan
Nov pristop v rehabilitaciji - terapija s pomočjo psa
Mateja Drljepan
Pogled v maternico z magnetnoresonančno preiskavo
Taja Jordan, Tina Vipotnik Vesnaver
Saša Zorjan
Saša Zorjan
Nevroestetika: ko nevroznanost obišče galerijo
Anja Voljavec, Hana Hawlina, Nika Vrabič
Ali so psihogeni neepileptični napadi res psihogeni?
Saška Vipotnik, Gal Granda
Kako nam lahko glasna glasba »vzame« sluh in povzroči tinitus
Nejc Steiner, Saba Battelino
eSinapsa, 2016-11
Mara Bresjanac
Kako ultrazvok odpira pot v možgane
Kaja Kolmančič
Kako je epigenetika spremenila nevroznanost
Metka Ravnik Glavač
Ondinino prekletstvo ali sindrom prirojene centralne hipoventilacije
Katja Pavšič, Barbara Gnidovec Stražišar, Janja Pretnar Oblak, Fajko F. Bajrović
Zika virus in magnetnoresonančna diagnostika nepravilnosti osrednjega živčevja pri plodu
Rok Banko, Tina Vipotnik Vesnaver
Motnje ravnotežja otrok in odraslih
Nejc Steiner, Saba Battelino
eSinapsa, 2016-12
Vloga magnetnoresonančne spektroskopije pri obravnavi možganskih tumorjev
Gašper Zupan, Katarina Šurlan Popovič
Tiskanje tridimenzionalnih modelov v medicini
Andrej Vovk
Aleš Oblak
Kevin Klarič
Sinestezija: umetnica, ki ne želi odrasti
Tisa Frelih
Računska psihiatrija: od nevroznanosti do klinike
Nastja Tomat
Kognitivni nadzor: od vsakdanjega življenja do bolezni
Vida Ana Politakis
eSinapsa, 2017-13
Internet: nadgradnja ali nadomestek uma?
Matej Perovnik
Vloga črevesnega mikrobioma pri odzivu na stres
Vesna van Midden
Stres pušča posledice tako na človeškem kot živalskem organizmu
Jasmina Kerčmar
Prikaz normalne anatomije in bolezenskih stanj obraznega živca z magnetno resonanco
Rok Banko, Matej Vrabec
Psihedelična izkušnja in njen zdravilni potencial
Anja Cehnar, Jona Basle
Vpliv hiperglikemije na delovanje možganov
Jasna Šuput Omladič, Simona Klemenčič
Nevrofibromatoza: napredujoče obolenje centralnega in perifernega živčevja
Nejc Steiner, Saba Battelino
Fenomen žrtvenega jagnja v dobi interneta
Dolores Trol
Tesnoba staršev in strategije spoprijemanja, ko pri otroku na novo odkrijejo epilepsijo
Daša Kocjančič, Petra Lešnik Musek, Vesna Krkoč, David Gosar
eSinapsa, 2017-14
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
eSinapsa, 2018-15
Susceptibilno poudarjeno magnetnoresonančno slikanje pri bolniku z ALS
Alja Vičič, Jernej Avsenik, Rok Berlot
Sara Fabjan
Reverzibilni cerebralni vazokonstrikcijski sindrom – pot do diagnoze
Maja Cimperšek, Katarina Šurlan Popovič
Liam Korošec Hudnik
Kognitivno funkcioniranje pri izgorelosti
Marina Horvat
eSinapsa, 2019-16
Maša Čater
Saša Koprivec
Infekcije osrednjega živčnega sistema s flavivirusi
Maja Potokar
Raziskava: Kako depresija vpliva na kognitivne sposobnosti?
Vida Ana Politakis
Razvoj depresije pri otrocih z vidika navezovalnega vedenja
Neža Grgurevič
Sonja Prpar Mihevc
Umetno inteligentna nevroznanost: srečanje nevronskih mrež in možganske fiziologije
Kristijan Armeni
Čebelji strup pri preventivi nevrodegenerativnih bolezni in priložnost za klinično prakso
Matjaž Deželak
eSinapsa, 2019-17
IgG4+ – skupni imenovalec diagnoz iz preteklosti
Cene Jerele, Katarina Šurlan Popovič
Nov molekulski mehanizem delovanja ketamina v astrocitih
Matjaž Stenovec
Praktični pristop k obravnavi utrujenosti in motenj spanja pri bolnikih z multiplo sklerozo
Nik Krajnc, Leja Dolenc Grošelj
Jure Pešak
eSinapsa, 2020-18
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
eSinapsa, 2020-19
Ob mednarodnem dnevu znakovnih jezikov
Anka Slana Ozimič
Teorija obetov: kako sprejemamo tvegane odločitve
Nastja Tomat
Sara Fabjan
Matjaž Deželak
Nina Stanojević, Uroš Kovačič
Od človeških nevronov do možganskih organoidov – nova obzorja v nevroznanosti
Vesna M. van Midden
Splošna umetna inteligenca ali statistične jezikovne papige?
Kristijan Armeni
Zunajcelični vezikli kot prenašalci zdravilnih učinkovin preko krvno-možganske prepreke
Saša Koprivec
Matjaž Deželak
eSinapsa, 2021-20
Migrena: starodavna bolezen, sodobni pristopi k zdravljenju
Eva Koban, Lina Savšek
Zgodnji razvoj socialnega vedenja
Vesna Jug
Nastja Tomat
Mikrosplet: povezovanje preko mikrobioma
Tina Tinkara Peternelj
Stimulacija možganov kot način zdravljenja depresije
Saša Kocijančič Azzaoui
eSinapsa, 2021-21
eSinapsa, 2022-22
Sodobni vidiki motenj hranjenja
Karin Sernec
Ples in gibalni dialog z malčki
Neva Kralj
Atul Gawande
Jezikovna funkcija pri Alzheimerjevi bolezni
Gašper Tonin
Dostava terapevtikov preko krvno-možganske pregrade
Matjaž Deželak
eSinapsa, 2022-23
Akutni ishemični infarkt hrbtenjače pri zdravih otrocih – kaj lahko pove radiolog?
Katarina Šurlan Popovič, Barbara Šijaković
eSinapsa, 2023-24
Možganska omrežja pri nevrodegenerativnih boleznih
Tomaž Rus, Matej Perovnik
Morske živali kot navdih za nevroznanstvenike: morski konjiček, morski zajček in klobučnjak
Tina Bregant
Metoda Feldenkrais: gibanje in nevroplastičnost
Mateja Pate
Etično naravnana animalna nevroznanost
Maša Čater
Helena Motaln, Boris Rogelj
eSinapsa, 2023-25
Urban Košak, Damijan Knez, Anže Meden, Simon Žakelj, Jurij Trontelj, Jure Stojan, Maja Zakošek Pipan, Kinga Sałat idr.
eSinapsa, 2024-26
Naravno okolje kot vir zdravja in blagostanja
Karin Križman, Grega Repovš, Gaja Zager Kocjan, Gregor Geršak
Katja Peganc Nunčič, Damjan Osredkar
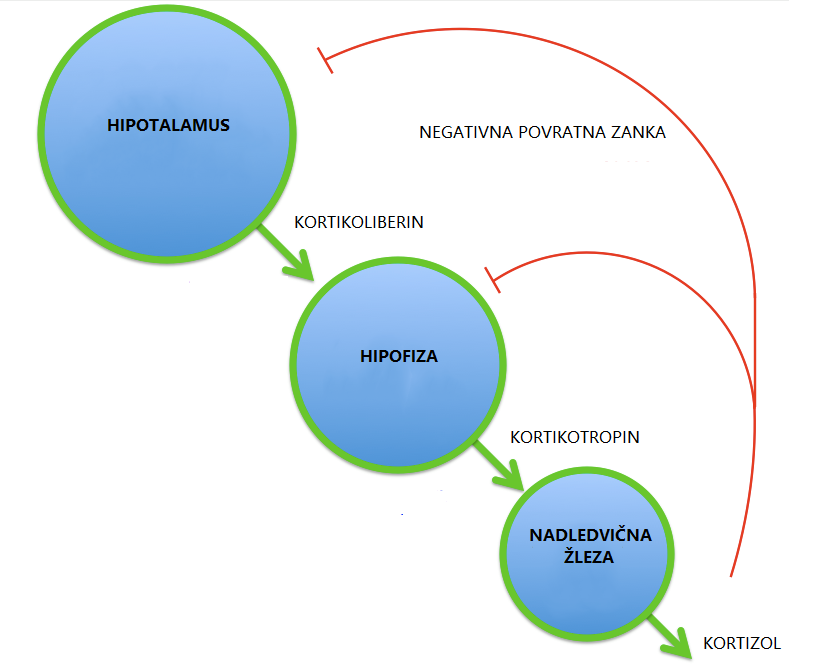
Začetke preučevanja fiziologije stresa označuje delo Walterja Cannona, ki je identificiral vlogo simpatičnega živčnega sistema pri oblikovanju odziva »boj ali beg«, in delo Hansa Seyla, ki je pokazal na pomembnost glukokortikoidov1 ter osi hipotalamus-hipofiza-nadledvična žleza3 pri uravnavanju stresnega odziva.
Os hipotalamus-hipofiza-nadledvična žleza je sistem povezav med omenjenimi strukturami. Prek interakcij z drugimi sistemi (metabolni, imunski) uravnava fiziološke odzive, ki omogočajo prilagajanje različnim stresorjem.2 Z aktivacijo osi se energija organizma preusmeri iz rutinskega ohranjanja homeostaze v procese, ki so potrebni za preživetje – npr. povišana kardiovaskularna aktivnost in metabolizem glukoze. Komunikacija vzdolž osi poteka prek različnih signalnih molekul.3 V hipotalamusu nastajajoči kortikoliberin (ang. corticotropin-releasing hormone, s kratico CRH) spodbuja sproščanje hormona kortikotropina (ang. adrenocorticotropic hormone, s kratico ACTH) v hipofizi, ki vpliva na sproščanje glukokortikoidov v nadledvičnih žlezah. Glukokortikoidi so steroidni hormoni, ki igrajo pomembno vlogo pri uravnavanju stresnega odziva, glavni predstavnik pri ljudeh pa je kortizol.7
Odkritja, da lahko stresni odziv sprožijo psihološki dejavniki – izguba nadzora, predvidljivosti in socialne podpore – so pokazala na vlogo psihologije pri preučevanju stresa; ugotovitve, da daljše doživljanje stresa poviša verjetnost za določene bolezni, pa so opozorila na pomen preučevanje stresa z vidika medicine in spodbudila porajanje novih podpodročij, na primer psihonevroimunologije.1
Vpliv stresa na možgane
Vpliv stresa se kaže na ravni molekul, nevronov, strukture možganov in celotnega organizma. Veliko raziskav se je osredotočalo na tri možganske strukture – hipokampus, amigdalo in prefrontalni reženj. 2 Ta področja tvorijo tridelno kortikolimbično omrežje, ki pri različnih vrstah uravnava tako odzivanje na akutne kot dolgotrajne stresorje.3 Hipokampus igra vlogo pri vkodiranju kompeksnih informacij iz okolja, ki so povezane z grožnjami, prek glukokortikoidnih receptorjev pa podaja povratne informacije osi hipotalamus-hipofiza-nadledvična žleza, ki uravnava stresni odziv.
Veliko raziskav potrjuje negativen vpliv stresa na procese deklarativnega spomina, ki potekajo v hipokampusu, in na izvršilne funkcije ter uravnavanje vedenja, za kar je zadolžen frontalni reženj.1 Stres, posledica katerega je sproščanje velikih količin glukokortikoidov, bo v hipokampusu in nekaterih delih frontalnega režnja zmanjševal plastičnost sinaps, povzročal atrofijo dendritov in celo zmanjševal prostornino sivine ali celotne strukture možganov. Takšne spremembe so med drugim podlaga kognitivne oškodovanosti pri depresiji in posttravmatski stresni motnji (v nadaljevanju PTSM).1 Kognitivna rigidnost je povezana s krčenjem in zmanjšanjem razvejanosti dendritov v medialnem prefrontalnem režnju, prekomerna opreznost in previdnost pa s širjenjem dendritov v orbitofrontalnem režnju. Spremembe nevronov v prefrontalnem režnju so sicer reverzibilne, vendar so dendriti po okrevanju bolj oddaljeni od telesa celice kot prej.2 Tretja struktura, amigdala, pa sodeluje pri prepoznavanju potencialnih nevarnosti, oblikovanju fiziološkega in vedenjskega odziva nanje ter pri ustvarjanju spominov, ki olajšajo nadaljnje predvidevanje okolja in omogočajo ustrezno vedenje.3 V amigdali glukokortikoidi zvišujejo plastičnost sinaps in spodbujajo rast dendritov, kar vodi v spremembe v doživljanju strahu – v manjši potencial za interpretiranje okolja kot varnega in večjo verjetnost za strah v okoliščinah, kjer to ni potrebno. 1
Pomembno je preučevati tako vpliv akutnih kot kroničnih stresorjev. Raziskave, v katerih so preučevali učinek glukokortikoidov na izražanje genov v hipokampusu miši, so pokazale, da kronični stres lahko vpliva na odziv na nove, akutne stresorje. Pri miših, ki so bile najprej izpostavljene enaindvajsetdnevnemu stresu in potem okrevanju, so novi stresorji sprožili drugačen profil izražanja genov kot pri miših, ki niso bile izpostavljene kroničnemu stresu.2
Obrnjena U-krivulja in medosebne razlike v odzivu na stres
Takoj, ko je Seyle populariziral termin stres v biomedicini, se je začela razprava o opredelitvi stresa. Novo vprašanje, ki se poraja iz prvega, se nanaša na medosebne razlike v odzivanju na stres. Kaj je stres – za posameznika? Obstajajo situacije, na primer resna poškodba ali beg pred plenilcem, ki bodo v vsakem organizmu sprožile stresni odziv, v mnogih okoliščinah pa se pripadniki posamezne vrste razlikujejo v tem, katere dražljaje zaznavajo kot stresne, in v njihovi odpornosti ali ranljivosti za razvoj motenj, povezanih s stresom. Vzorec aktivacije mediatorjev stresnega odziva je odvisen od značilnosti, intenzitete in trajanja stresorja. V veliki meri lahko učinke stresorjev na možgane opišemo z obrnjeno U-krivuljo. Časovno omejen stres blage do zmerne intenzivnosti ima koristne učinke; če je stres popolnoma odsoten, prehud ali predolgo časa trajajoč, vpliva škodljivo. Odsotnost stresa večina doživlja kot premalo stimulativno, prehud stres pa kot preveč stimulativno okolje.1 Na podlagi tega sta se oblikovala dva izraza – eustres, ki je opredeljen kot prilagoditveni fiziološki odziv na okolje, in distres, pri katerem se pojavijo motnje v fiziološkem odzivu, kar povzroči, da prilagoditev na okolje ni več uspešna.3 Takšne učinke stresa lahko delno pojasnimo z obstojem dveh vrst receptorjev za glukokortikoide v hipokampusu. Prvi so mineralokortikoidni receptorji, ki večinoma delujejo v nestresnih okoliščinah. Njihova kapaciteta se napolni že pri blagih do zmernih stresorjih. Kapaciteta druge vrste receptorjev, ki se imenujejo glukokortikoidni receptorji, se do konca napolni šele ob izdatnem sproščanju glukokortikoidov, ki je posledica močnega stresa. Višja zasedenost mineralokortikoidnih receptorjev povečuje plastičnost sinaps, višja zasedenost glukokortikoidnih receptorjev pa jo zmanjšuje. Nasprotujoči si učinki dveh vrst receptorjev ustvarjajo obliko obrnjene U-krivulje. Tudi drugi predeli možganov se na stres odzivajo na podoben način, kar raziskovalci razlagajo z različnimi mehanizmi.
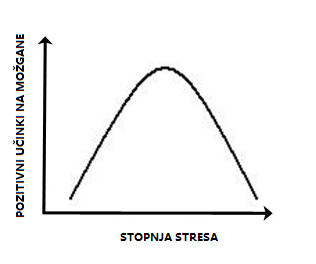
Slika 2. Učinki stresa na številne procese v možganih imajo obliko obrnjene U-krivulje. Prirejeno po Wikimedia Commons.
Stresa, ki je prehoden in ki ga doživljamo v za nas varnem okolju, ne doživljamo kot neprijetnega, temveč kot opreznost, zavzetost, čuječnost.1 Vprašanje, ki se pojavlja, je, kako pri posamezniku vzpostaviti ravnotežje med dolgočasjem in preokupiranostjo ter ohranjati položaj na vrhu krivulje. Predlog za nadaljnje raziskave je preučevanje dejavnikov, ki lahko vrh krivulje pri posamezniku premikajo na levo ali desno stran – v smer večje ranljivosti ali odpornosti. Ne gre za to, kako odpraviti stres, temveč kako optimizirati njegovo raven.1
S stresom povezane motnje
Stres se povezuje tako z razvojem možganov kot z nevroplastičnostjo v odraslosti. Škodljivi vplivi stresa v zgodnjih obdobjih življenja, še posebej v obporodni dobi, se lahko kažejo tudi v odraslosti, spremenijo potek staranja možganov in prek negenetskega prenašanja fizioloških in vedenjskih značilnosti vplivajo celo na več generacij. Raziskave o vplivu stresa na amigdalo nakazujejo na stres kot dejavnik tveganja za nastanek različnih patoloških stanj, kot so depresivne in anksiozne motnje, shizofrenija in številna odvisniška vedenja. Raziskave so se osredotočale bodisi na akutni stres, ki sproži epizodo motnje, bodisi na povezavo med stresom v zgodnjem obdobju življenja in boleznijo v odraslosti.1 Oblikovanje varne navezanosti na eni strani ter zanemarjanje in zloraba na drugi se povezujejo s posameznikovim doživljanjem in vedenjem v socialnem okolju pozneje v življenju.2 Travmatske izkušnje, zanemarjanje v otroštvu in nizka stopnja zaznane socialne podpore so stresorji, ki se pogosto pojavljajo pri posameznikih, ki razvijejo anskiozne motnje ali PTSM.3 Rastoče polje raziskav preučuje epigenetske mehanizme, ki so lahko v ozadju dolgoročnih učinkov stresa. Dokazi o nevroplastičnosti in celo nevrogenezi v odraslosti kažejo na možnosti lajšanja, ustavljanja in izničevanja posledic stresa v zgodnjih obdobjih življenja.1
Različne študije so preučevale nevrološke korelate s stresom povezanih motenj. Pri posameznikih s PTSM je na primer opazna hiperaktivnost amigdale med pogojevanjem strahu in ugašanjem pogojnega odziva, kar se povezuje z vztrajanjem občutka strahu, ki ga doživljajo.3 Motnje v ugašanju strahu pri PTSM so povezane tudi s hipoaktivnostjo hipokampusa in ventromedialnega prefrontalnega režnja.3 Pri nastanku duševnih bolezni, kjer gre za interakcijo med genetskimi in okoljskimi vplivi, je torej pomembno upoštevati posameznikovo občutljivost na stres in njegovo stopnjo izpostavljenosti.1 Pri ljudeh medosebne razlike v odzivnosti amigdale na obrazne izraze, povezane z grožnjo, napovedujejo ranljivost za stres v prihodnosti. Udeleženci študije z relativno aktivnejšo amigdalo naj bi imeli v prihodnjih štirih letih ob izpostavljenosti stresorjem (npr. menjava službe ali selitev) večjo verjetnost za razvoj simptomov depresije ali anksioznosti. Variabilnost aktivnosti amigdale se je izkazala kot boljši napovednik ranljivosti kot samoporočanje o simptomih, nedavne stresne izkušnje ali travma v otroštvu. V drugi študiji na vzorcu vojakov, ki so se udeležili spopada, je bila večja aktivnost amigdale ob procesiranju groženj povezana z verjetnostjo za razvoj simptomov, podobnih PTSM.3
Z razumevanjem stresa do izboljševanja duševnega zdravja
Raziskovanje mehanizmov občutljivosti in plastičnosti možganov v kontekstu stresnega odziva je pomembno za oblikovanje intervencij za obravnavo motenj, povezanih s stresom. V stresnih okoliščinah poteka strukturno preoblikovanje nevronske arhitekture, namen česar je uspešna prilagoditev na izzive iz okolja. Vztrajanje teh sprememb po tem, ko stresorji izginejo, je lahko znak prenizke odpornosti na stres. Z namenom prilagajanja na okolje in ponovne vzpostavitve ravnovesja v organizmu potekajo procesi v osi hipotalamus-hipofiza-nadledvična žleza, avtonomnem živčnem sistemu ter metabolnem in imunskem sistemu, ki jih skupno imenujemo alostaza. Ob veliki količini stresa lahko pride do napak v uravnavanju teh procesov in do patofizioloških sprememb v organizmu, kar imenujemo alostatska preobremenitev. Na alostazo in alostatsko preobremenitev med drugim vpliva način življenja – kajenje, pitje alkohola, prehrana in spalne navade.2 Raziskave na vzorcih zaposlenih v izmenah so pokazale, da motnje spanja in cirkadianega ritma povečujejo tveganje za razvoj psihiatričnih, srčno-žilnih in drugih fizioloških sindromov. V nekaterih raziskavah so pri živalih z motenim cirkadianim ritmom poleg metabolnih sprememb opažali morfološke spremembe prefrontalnega režnja, podobne tistim, ki nastanejo z izpostavljenostjo kroničnemu stresu – na primer krčenje dendritov.3
Ko se izpostavljenost stresorjem konča, se nevronska arhitektura ne vrne v svoje začetno stanje, temveč s procesi nevroplastične adaptacije nastane novo, drugačno stanje. Adaptivno plastičnost možganov, ki poteka brez zunanje pomoči, lahko opredelimo kot prožnost (ang. resilience). Ta se zmanjšuje s staranjem, okrnjena pa je pri motnjah čustvovanja. V skladu s prepričanjem, da je prožnost znak zdravih možganov, se raziskovalci na področju duševnega zdravja osredotočajo na njeno ohranjanje in izboljševanje. Nekateri avtorji predlagajo, da v nadaljnjih raziskavah preučijo možnosti farmakološke in psihoterapevtske obravnave anksioznih motenj, depresije in PTSM, ki bodo temeljile na izboljševanju nevroplastičnosti.2 Pri obravnavi s stresom povezanih motenj se pogosto uporabljajo vedenjske intervencije, ki temeljijo na principu ugašanja, pri čemer gre za prekinitev povezave med brezpogojnim in pogojnim dražljajem. Težava je v začasnosti učinka ugašanja – strah se spontano ali v novih okoljih lahko ponovno pojavi.5 Različne študije na glodavcih in ljudeh so pokazale, da ugašanje lahko znatno oslabi s strahom povezane spomine, če poteka v časovnem intervalu rekonsolidacije, ki sledi ponovni aktivaciji spominov.4 5 6 Upoštevanje ustreznih časovnih oken je torej ključno pri načrtovanju terapevtskih intervencij.6 Poleg psihoterapije se uporabljajo tudi druge metode. Repetitivna transkranialna magnetna stimulacija dorzolateralnega prefrontalnega režnja, ki uravnava delovanje amigdale, lahko pri pacientih s PTSM zmanjša vedenjsko simptomatiko in čezmerno aktivnost osi hipotalamus-hipofiza-nadledvična žleza. Pri nekaterih pacientih s hudo, na zdravljenje odporno, depresijo se je kot učinkovito zdravljenje izkazala globoka možganska stimulacija in raziskovalci upajo na njen terapevtski potencial tudi pri drugih motnjah, npr. PTSM.3
Ugotovitve o skupni genetski arhitekturi in nevronskih omrežjih za uravnavanje stresnega odziva prek različnih vrst govorijo v prid uporabnosti živalskih modelov pri preučevanju vpliva stresa na ljudi. Določene funkcije amigdale, hipokampusa in prefrontalnega režnja pri uravavanju stresnega odziva so analogne tistim pri ljudeh. Nekateri avtorji menijo, da povezovanje prekliničnih študij na glodavcih in študij na zdravih posameznikih ter kliničnih populacijah lahko ponudi odgovore o biološki podlagi motenj, povezanih s stresom. Medosebne razlike v strukturnih in funkcijskih značilnostih nevronskih omrežij, ki uravnavajo stresni odziv, so morda pot do bioloških označevalcev motenj, povezanih s stresom.3
-
___
-
Sapolsky, R. M. (2015). Stress and the brain: individual variability and the inverted-U. Nature Neuroscience, 18(10), 1344–1346. ↩
-
Hariri, A. R. In Holmes, A. (2015). Finding translation in stress research. Nature Neuroscience, 18(10), 1347–1352. ↩
-
McEwen, B. S., Bowles, N. P., Gray, J. D., Hill, M. N., Hunter, R. G., Karatsoreos, I. N. in Nasca, C. (2015). Mechanisms of stress in the brain. Nature Neuroscience, 18(10), 1353–1363. ↩
-
Glucocorticoid (b.d.). Miller-Keane Encyclopedia and Dictionary of Medicine, Nursing, and Allied Health, Seventh Edition (2003). Pridobljeno 26. 10. 2017 z https://medical-dictionary.thefreedictionary.com/glucocorticoid ↩
-
Monfils, M. H., Cowansage, K. K., Klann, E. In LeDoux, J. E. (2009). Extinction-reconsolidation boundaries: key to persistent attenuation of fear memories. Science, 324(5929), 951–955. ↩
-
Agren, T., Engman, Frick, A., Bjorkstrand, J., Larsson, E. M., Furmark, T. In Fredrikson, M. (2012). Disruption of reconsolidation erases a fear memory trace in the human amygdala. Science, 337(6101), 1550–1552. ↩
-
Post, R. M. in Kegan, R. (2017). Prevention of recurrent affective episodes using extinction training in the reconsolidation window: A testable psychotherapeutic strategy. Psychiatry Research, 249, 327–336. ↩
Nastja Tomat, dipl. psih.