Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Nevrološke posledice COVID-19
članki
eSinapsa, 2011-1
Zvezdan Pirtošek
Eksoskeleti – inteligentne bionske naprave
Marko Munih
O aktualnih dilemah draženja globokih možganskih struktur pri obsesivno - kompulzivni motnji
Nadja Jarc
Sledite svojo srečo ... z iPhone
Urban Kordeš
eSinapsa, 2011-2
Renata Salecl
Gašper Tkačik
Astrociti – spregledane zvezde nevrobiologije
Marko Kreft, Robert Zorec
Sašo Dolenc
Meditacija - malo truda, veliko koristi
Luka Dimic
eSinapsa, 2011-3
Mara Bresjanac
Martina Starc
Rok Berlot
Varnost uporabe generičnih protiepileptičnih zdravil
Mojca Kržan, Matevž Kržan
Možgani, računalniki - nekaj vmes
Miha Pelko
eSinapsa, 2012-4
Ali so moški in ženski možgani različni?
Gregor Majdič
O kognitivnih motnjah pri bolnikih s Parkinsonovo boleznijo
Dejan Georgiev
Akutno možgansko kap lahko uspešno zdravimo
Nina Vujasinovič, Bojana Žvan
Vloga nevropsihološke diagnostike pri odkrivanju zgodnjih znakov alzheimerjeve bolezni
Simon Brezovar
eSinapsa, 2013-5
Učinek placeba brez lažnih zdravil in zavajanja
Mara Bresjanac
Subarahnoidna krvavitev zaradi tromboze venskih sinusov
Mateja Repar, Anita Resman Gašperčič
Srečanje dveh velikanov: možganov in imunskega sistema
Matej Markota
Novo odkritje na področju sporadičnih prionskih bolezni
Jana Jerše, Nadja Jarc
eSinapsa, 2013-6
Odstranjevanje možganskih tumorjev pri budnem bolniku
Andrej Vranič, Jasmina Markovič, Blaž Koritnik
Zmedena bolnica, ki nič ne vidi ali PRES
Manja Hribar, Vid Zgonc
Manja Hribar
Sistemska skleroza in ishemična možganska kap - vzročna povezanost ali le koincidenca?
Mateja Repar, Janja Pretnar Oblak
Netravmatska lokalizirana konveksitetna subarahnoidna krvavitev
Mateja Repar, Fajko F. Bajrović
Klemen Grabljevec
Z omejevanjem spodbujajoča terapija pri bolnikih po nezgodni možganski poškodbi
Dejana Zajc, Klemen Grabljevec
eSinapsa, 2014-7
Možgani v mreži navezanosti, ki nas zaznamuje
Barbara Horvat
Vpliv senzoričnega dotoka na uglasitev možganskih povezav
Peter Gradišnik
Človeški konektom ali kakšne so zveze v naših možganih
Blaž Koritnik
Niko Lah
Torkove delavnice za osnovnošolce
Mateja Drolec Novak, Vid V. Vodušek
Da ne pozabim! Tehnike za pomladitev spomina
Klara Tostovršnik, Hana Hawlina
Površina socialne nevroznanosti
Manuel Kuran
Clarity - bistri možgani Karla Deisserotha
Gregor Belušič
Barbara Gnidovec Stražišar
Bojana Žvan
Nevroplastičnost po možganski kapi
Marjan Zaletel
Klinično psihološka obravnava pacientov po možganski kapi in podpora pri vračanju na delovno mesto
Barbara Starovasnik Žagavec
Možgani: organ, s katerim ljubimo
Andraž Matkovič
Marija Šoštarič Podlesnik
Gibalno-kognitivna vadba: praktična delavnica
Mitja Gerževič, Marina Dobnik
Anton Grad
Nevrologija, imunologija, psihiatrija …
Bojan Rojc
Andraž Stožer, Janez Bregant
Dominika Novak Pihler
Možganska kap – »kako ostati v omrežju?«
Nina Ozimic
Klara Tostovršnik
eSinapsa, 2014-8
Znotrajžilno zdravljenje možganskih anevrizem
Tamara Gorjanc, Dimitrij Lovrič
Obravnava hladnih možganskih anevrizem
Bojana Žvan, Janja Pretnar Oblak
Ali deklice z Rettovim sindromom govorijo z očmi?
Anka Slana, Urška Slana
Progresivna multifokalna encefalopatija
Urša Zabret, Katarina Šurlan Popovič
Ne ubijaj – poskusi na živalih
Martina Perše
Poizkusi na živalih - za in proti
Simon Horvat
eSinapsa, 2015-9
Kako deluje navigacijski sistem v naših možganih
Simon Brezovar
Vsakodnevno delo slepe osebe / s slepo osebo
Denis Kamnar
Uroš Marušič
Manca Tekavčič Pompe
Toni Pustovrh
Marko Hawlina
Od svetlobe do podobe ali kako vidijo svet naši možgani
Simon Brezovar
Janja Hrastovšek
Zala Kurinčič
Pogledi na mejno osebnostno motnjo
Jerica Radež, Peter Kapš
Uvid kot socialno psihološki fenomen
Vid Vodušek
Uvod v vidno-prostorske funkcije s praktičnimi primeri
Ana Bujišić, Sanja Roškar
eSinapsa, 2015-10
Difuzijsko magnetnoresonančno slikanje
Rok Berlot
Katja Pavšič
Radiološko izolirani sindrom - ali ga moramo poznati?
Matej Vouk, Katarina Šurlan Popovič
Kako izgledajo možgani, ki govorijo več jezikov?
Gašper Zupan
Nov pristop v rehabilitaciji - terapija s pomočjo psa
Mateja Drljepan
Pogled v maternico z magnetnoresonančno preiskavo
Taja Jordan, Tina Vipotnik Vesnaver
Saša Zorjan
Saša Zorjan
Nevroestetika: ko nevroznanost obišče galerijo
Anja Voljavec, Hana Hawlina, Nika Vrabič
Ali so psihogeni neepileptični napadi res psihogeni?
Saška Vipotnik, Gal Granda
Kako nam lahko glasna glasba »vzame« sluh in povzroči tinitus
Nejc Steiner, Saba Battelino
eSinapsa, 2016-11
Mara Bresjanac
Kako ultrazvok odpira pot v možgane
Kaja Kolmančič
Kako je epigenetika spremenila nevroznanost
Metka Ravnik Glavač
Ondinino prekletstvo ali sindrom prirojene centralne hipoventilacije
Katja Pavšič, Barbara Gnidovec Stražišar, Janja Pretnar Oblak, Fajko F. Bajrović
Zika virus in magnetnoresonančna diagnostika nepravilnosti osrednjega živčevja pri plodu
Rok Banko, Tina Vipotnik Vesnaver
Motnje ravnotežja otrok in odraslih
Nejc Steiner, Saba Battelino
eSinapsa, 2016-12
Vloga magnetnoresonančne spektroskopije pri obravnavi možganskih tumorjev
Gašper Zupan, Katarina Šurlan Popovič
Tiskanje tridimenzionalnih modelov v medicini
Andrej Vovk
Aleš Oblak
Kevin Klarič
Sinestezija: umetnica, ki ne želi odrasti
Tisa Frelih
Računska psihiatrija: od nevroznanosti do klinike
Nastja Tomat
Kognitivni nadzor: od vsakdanjega življenja do bolezni
Vida Ana Politakis
eSinapsa, 2017-13
Internet: nadgradnja ali nadomestek uma?
Matej Perovnik
Vloga črevesnega mikrobioma pri odzivu na stres
Vesna van Midden
Stres pušča posledice tako na človeškem kot živalskem organizmu
Jasmina Kerčmar
Prikaz normalne anatomije in bolezenskih stanj obraznega živca z magnetno resonanco
Rok Banko, Matej Vrabec
Psihedelična izkušnja in njen zdravilni potencial
Anja Cehnar, Jona Basle
Vpliv hiperglikemije na delovanje možganov
Jasna Šuput Omladič, Simona Klemenčič
Nevrofibromatoza: napredujoče obolenje centralnega in perifernega živčevja
Nejc Steiner, Saba Battelino
Fenomen žrtvenega jagnja v dobi interneta
Dolores Trol
Tesnoba staršev in strategije spoprijemanja, ko pri otroku na novo odkrijejo epilepsijo
Daša Kocjančič, Petra Lešnik Musek, Vesna Krkoč, David Gosar
eSinapsa, 2017-14
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
eSinapsa, 2018-15
Susceptibilno poudarjeno magnetnoresonančno slikanje pri bolniku z ALS
Alja Vičič, Jernej Avsenik, Rok Berlot
Sara Fabjan
Reverzibilni cerebralni vazokonstrikcijski sindrom – pot do diagnoze
Maja Cimperšek, Katarina Šurlan Popovič
Liam Korošec Hudnik
Kognitivno funkcioniranje pri izgorelosti
Marina Horvat
eSinapsa, 2019-16
Maša Čater
Saša Koprivec
Infekcije osrednjega živčnega sistema s flavivirusi
Maja Potokar
Raziskava: Kako depresija vpliva na kognitivne sposobnosti?
Vida Ana Politakis
Razvoj depresije pri otrocih z vidika navezovalnega vedenja
Neža Grgurevič
Sonja Prpar Mihevc
Umetno inteligentna nevroznanost: srečanje nevronskih mrež in možganske fiziologije
Kristijan Armeni
Čebelji strup pri preventivi nevrodegenerativnih bolezni in priložnost za klinično prakso
Matjaž Deželak
eSinapsa, 2019-17
IgG4+ – skupni imenovalec diagnoz iz preteklosti
Cene Jerele, Katarina Šurlan Popovič
Nov molekulski mehanizem delovanja ketamina v astrocitih
Matjaž Stenovec
Praktični pristop k obravnavi utrujenosti in motenj spanja pri bolnikih z multiplo sklerozo
Nik Krajnc, Leja Dolenc Grošelj
Jure Pešak
eSinapsa, 2020-18
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
eSinapsa, 2020-19
Ob mednarodnem dnevu znakovnih jezikov
Anka Slana Ozimič
Teorija obetov: kako sprejemamo tvegane odločitve
Nastja Tomat
Sara Fabjan
Matjaž Deželak
Nina Stanojević, Uroš Kovačič
Od človeških nevronov do možganskih organoidov – nova obzorja v nevroznanosti
Vesna M. van Midden
Splošna umetna inteligenca ali statistične jezikovne papige?
Kristijan Armeni
Zunajcelični vezikli kot prenašalci zdravilnih učinkovin preko krvno-možganske prepreke
Saša Koprivec
Matjaž Deželak
eSinapsa, 2021-20
Migrena: starodavna bolezen, sodobni pristopi k zdravljenju
Eva Koban, Lina Savšek
Zgodnji razvoj socialnega vedenja
Vesna Jug
Nastja Tomat
Mikrosplet: povezovanje preko mikrobioma
Tina Tinkara Peternelj
Stimulacija možganov kot način zdravljenja depresije
Saša Kocijančič Azzaoui
eSinapsa, 2021-21
eSinapsa, 2022-22
Sodobni vidiki motenj hranjenja
Karin Sernec
Ples in gibalni dialog z malčki
Neva Kralj
Atul Gawande
Jezikovna funkcija pri Alzheimerjevi bolezni
Gašper Tonin
Dostava terapevtikov preko krvno-možganske pregrade
Matjaž Deželak
eSinapsa, 2022-23
Akutni ishemični infarkt hrbtenjače pri zdravih otrocih – kaj lahko pove radiolog?
Katarina Šurlan Popovič, Barbara Šijaković
eSinapsa, 2023-24
Možganska omrežja pri nevrodegenerativnih boleznih
Tomaž Rus, Matej Perovnik
Morske živali kot navdih za nevroznanstvenike: morski konjiček, morski zajček in klobučnjak
Tina Bregant
Metoda Feldenkrais: gibanje in nevroplastičnost
Mateja Pate
Etično naravnana animalna nevroznanost
Maša Čater
Helena Motaln, Boris Rogelj
eSinapsa, 2023-25
Urban Košak, Damijan Knez, Anže Meden, Simon Žakelj, Jurij Trontelj, Jure Stojan, Maja Zakošek Pipan, Kinga Sałat idr.
eSinapsa, 2024-26
Naravno okolje kot vir zdravja in blagostanja
Karin Križman, Grega Repovš, Gaja Zager Kocjan, Gregor Geršak
Katja Peganc Nunčič, Damjan Osredkar
Simptomi trenutno najbolj aktualne infekcijske bolezni COVID-19, ki jo povzroča okužba z virusom SARS-CoV-2, se podobno kot pri gripi kažejo predvsem kot splošna dihalna prizadetost, vse bolj pa je jasno, da lahko bolezen huje prizadene tudi živčni sistem. Akutni simptomi so običajno nelagodno počutje, utrujenost, glavobol, zmedenost z omotico ter izguba vonja in okusa 1, najbolj skrb vzbujajoče pa so morebitne dolgotrajnejše poškodbe možgan, katerih niti ne moremo poznati, saj se je ta virus pojavil šele pred enim letom. Praktično dnevno, in to iz vseh delov sveta, poročajo o nevroloških posledicah COVID-19, vendar gre največkrat za posamezne primere, s pomanjkljivimi podatki, opisane na nekonsistenten način, tako da si njihovi zaključki pogosto nasprotujejo. Namen tega prispevka je strniti dosedanje ugotovitve in jih objektivno kritično ovrednotiti. Z diagnostičnega vidika je bistveno védenje, katere nevrološke patologije se pojavljajo in s kakšno verjetnostjo, z vidika zdravljenja in preventive pa je ključno poznavanje molekularne in celične patogeneze.
Nevrološki simptomi COVID-19
Nevrološki znaki COVID-19 so bili opaženi pri približno tretjini hospitaliziranih bolnikov s hujšim potekom bolezni, pojavijo pa se lahko tudi pri sicer respiratorno asimptomatskih okužbah s SARS-CoV-2 2. Posledice so večinoma prehodne, vendar bolezen ne izbira – tudi pri mlajših ljudeh in z respiratorno blažjim potekom bolezni lahko pride do hujših nevroloških zapletov 3.
Encefalopatija in encefalitis. Stanje encefalopatije vključuje kognitivne spremembe posameznika, kot so zmedenost, dezorientacija, razdražljivost (»živčnost«) in omotičnost z zaspanostjo. Pri milejših in zmernih oblikah COVID-19 se encefalopatija pojavlja v manj kot 5% primerov 1, nasprotno pa je stalnica pri huje prizadetih bolnikih 2. Zaenkrat še ni povsem jasno, ali je encefalopatija posledica prizadetosti ostalih organov, ali pa je povezana z neposredno virusno okužbo in vnetjem možgan – stanje, ki ga strokovno imenujemo infekcijski encefalitis. Opisanih je bilo že kar nekaj primerov bolnikov s COVID-19, ki po sprejetih kriterijih ustrezajo diagnozi infekcijskega encefalitisa 4 5 6 7 8, s simptomi spremenjene kognicije, vročine, epileptičnih napadov, prisotnosti levkocitov v možgansko-hrbtenjačni tekočini (angl. Cerebrospinal Fluid, CSF) in abnormalnosti pri slikanju s funkcionalno magnetno resonanco 9. V večini primerov virusa v možganih ali CSF niso našli, zaenkrat sta potrjena zgolj dva takšna primera, pa še pri teh dveh je bila količina virusne RNA majhna 6 7. Pri kritičnih oblikah COVID-19 se pojavljajo še delirij, hujša zmedenost z dezorientacijo in koma 1 2 10, vsi pa so tesno povezani s hipoksijo (pomanjkanje kisika), nizkim krvnim tlakom, odpovedjo ledvic, velikimi odmerki pomirjeval ter z daljšo nepokretnostjo in osamitvijo 11.
Možganska kap. Možganska kap je pri COVID-19 v primerjavi z gripo približno sedemkrat pogostejša, in sicer se pojavi pri 1–3% hospitaliziranih bolnikov in pri 6% kritično obolelih 12 13. Seveda je pojav ishemične možganske kapi pogostejši pri starejših bolnikih in pri tistih z obstoječimi srčno-žilnimi boleznimi, a so nenavadne embolične dogodke opazili tudi pri mlajših in drugače zdravih bolnikih 14. Ne samo ishemična, tudi hemoragična možganska kap je pogosta pri COVID-19, slikanje z magnetno resonanco možgan umrlih je namreč pokazalo možganske krvavitve v približno desetini primerov 15.
Sistemska hipoksija. Centralni živčni sistem je pri bolnikih s COVID-19 prizadet tudi zaradi sistemskih posledic okužbe, predvsem dihalnega sistema. Pri hujših oblikah COVID-19, predvsem pri tistih, kjer je potrebno mehansko predihavanje z ventilatorji, je dihalna sposobnost pljuč močno omejena, kar lahko privede do sindroma akutne dihalne stiske (angl. Acute Respiratory Distress Syndrome, ARDS) s posledico zmanjšane saturacije krvi s kisikom 16. Sistemsko stanje hipoksije najbolj prizadene ravno možgane, ki so metabolno najbolj aktiven organ. Avtopsije umrlih COVID-19 bolnikov so pokazale obsežne poškodbe na kisik najbolj občutljivih predelov možgan, kot so neokorteks, hipokampus in mali možgani 17 18.
Zakasnjeni nevrološki učinki. Posledice okužbe s SARS-CoV-2 se lahko pojavijo tudi z zamikom, ko se akutna faza umiri. Do tako imenovanega post-infekcijskega vnetnega stanja pride zaradi dereguliranega imunskega sistema in pri COVID-19 sta bila opisana primera akutnega diseminacijskega encefalomielitisa 19 ter akutne nekrotične hemoragične encefalopatije 20. Kar se tiče perifernega živčnega sistema, je najpogostejši pojav imunsko pogojena nevropatija, imenovana Guillain-Barrejev sindrom, ki se kaže v različnih intenzitetah oslabelosti oziroma ohromitvi skeletnih mišic zaradi demielinizacije nevronov in povišane koncentracije proteinov v CSF 21. Hujša oblika tega sindroma, Miller-Fisherjeva varianta, z izraženo ataksijo (prizadetost hotenih gibov), oslabelostjo očesnih mišic in arefleksijo (odsotnostjo refleksov) je bila potrjena pri dveh bolnikih srednjih let 22.
Primerjava z ostalimi respiratornimi virusi. Nevrološki učinki SARS-CoV-2 niso posebna specifika tega virusa. Zakasnjeni nevrološki učinki (akutni diseminacijski encefalomielitis, akutna nekrotična hemoragična encefalopatija in Guillain-Barrejev sindrom) so značilni tudi za ostale koronaviruse 23. Virusi gripe povzročijo podobna stanja encefalopatije in encefalitisa kot SARS-CoV-2 in so tudi lahko prisotni v CSF 24. Nevrološke posledice okužbe s SARS-CoV-2 ne kažejo podobnosti z nevrotropnimi virusi, ki primarno ciljajo možgane (npr. Herpes simplex virus), ampak so skupne ostalim respiratornim virusom, s to razliko, da so posledice COVID-19 precej bolj izčrpavajoče. Pogostejši so predvsem trombotični dogodki, kar je pokazala skupna študija več zdravstvenih ustanov – težje prizadeti COVID-19 bolniki so imeli namreč signifikantno višjo pojavnost tromboz kot bolniki s hujšimi pljučnimi boleznimi zaradi ostalih vzrokov 25. Skladno s tem nekatere zdravstvene ustanove pri bolnikih s COVID-19 že uporabljajo krvne teste prisotnosti D-dimera (razpadni produkt fibrina, nastane po razgradnji krvnega strdka) in po potrebi izvajajo antikoagulantno zdravljenje 26.
Mehanizmi okužbe centralnega živčnega sistema s SARS-COV-2
Predpogoj za vstop SARS-CoV-2 v človeško celico je vezava na sidrni protein, ki je enak kot za SARS-CoV-1, to je zunajcelični encim za pretvorbo angiotenzina (angl. Angiotensin Converting Enzyme-2, ACE2) preko virusnega S-proteina, slednji pa za učinkovit vstop virusa v celico potrebuje še proteolitično razgradnjo s transmembransko serinsko proteazo-2 (angl. Transmembrane Protease, Serine 2, TMPRSS2) 27. ACE2 encim ni prisoten samo v celicah tkiv dihalnega sistema, ampak tudi v centralnem živčnem sistemu, in sicer v pericitah in gladkomišičnih celicah možganskih žil 28 ter v celicah horoidnega pleksusa in nevronih neokorteksa 29. Poleg ACE2 in TMPRSS2 lahko SARS-CoV-2 za okužbo celice uporabi tudi alternativne načine. Kot sidrni protein lahko uporabi še proteina basigin (BSG, CD147) 30 ali neurofilin-1 31, za proteolitično razgradnjo S-proteina pa pridejo v poštev tudi TMPRSS11A/B, katepsin B, katepsin L ter furin 32.
Kot že omenjeno, je SARS-CoV-2 strukturno in funkcionalno podoben ostalim koronavirusom, predvsem SARS-CoV-1, MERS-CoV in OC43, za katere je nevrotropizem (sposobnost okužbe živčnih celic) dobro poznan 33. Zgolj sklepamo lahko tudi na podobnost z vidika mehanizmov patofiziologije živčnega sistema, saj trdnih raziskovalnih dokazov še ni. Študije na organoidih in transgenih miših s človeškim ACE2 so sicer pokazale, da SARS-CoV-2 lahko okuži nevrone v odvisnosti od ACE2 in povzroči njihovo smrt 34. Izmed več tipov živčnih celic, ki so jih vzgojili iz človeških pluripotentnih matičnih celic, so bili za okužbo s SARS-CoV-2 najbolj dojemljivi dopaminergični nevroni, ne pa tudi kortikalni nevroni in celice mikroglija 35. Neposredna okužba živčnih celic je torej možna, vendar je v fizioloških pogojih ključno, da virus do nevronov sploh pride. Najverjetnejše poti okužbe centralnega živčnega sistema s SARS-CoV-2, že poznane pri ostalih respiratornih virusih, so predstavljene v nadaljevanju.
Vstop preko vohalnega (olfaktornega) sistema. Anosmija, izguba vohalne funkcije (z ali brez izgube okušalne funkcije) je zelo pogost simptom okužbe s SARS-CoV-2, tudi pri blažjih ali oblikah COVID-19, pri katerih ni potrebe po zdravniški oskrbi, lahko pa je edini simptom COVID-19 1. Na okužbo olfaktornega korteksa lahko sklepamo na osnovi slikanja z magnetno resonanco 36. Kot je že bilo dokazano pri drugih koronavirusih 37, lahko virus z endocitozo vstopi v živčne končiče, potuje po vohalnem živcu v aferentni smeri in se trans-sinaptično razširi v ostale predele možgan (Slika 1A) 41. Izražanje ACE2 in TMPRSS2 je bilo sicer potrjeno v nosni sluznici, tako na RNA kot na proteinskem nivoju, vendar naj bi bilo omejeno zgolj na epitelne celice, ne pa tudi na vohalne nevrone 38, čeprav neposredna okužba vohalnih nevronov ni izključena 39. Poleg vohalnega živca v nosno votlino sega tudi terminalni živec (lat. Nervus Terminalis) (Slika 1B), njuna skupna lastnost pa je, da sta edina od možganskih živcev, katerih dendritski izrastki nevronov sprejemajo dražljaje in jih po aksonu prevajajo v višje možganske centre neposredno, brez sodelovanja drugih čutilnih celic in brez sinaptičnih prenosov z drugimi nevroni. Poleg vohalnega in terminalnega živca je vstop virusa iz nosne votline v možgane možen še po dveh poteh. Prva je preko CSF (Slika 1C), ki se razprostira med živčnimi končiči do limfnih žil, in čeprav je tok usmerjen iz možgan v nosno votlino, lahko nekateri delci potujejo tudi v nasprotni smeri 40. Druga pot je preko močno ožiljenega nosnega epitela (Slika 1D), ki je gosto prepleten s tankimi kapilarami. Ko virus enkrat pride v kri, ga od centralnega živčnega sistema loči le še krvno-možganska prepreka (angl. Blood-Brain Barrier, BBB).
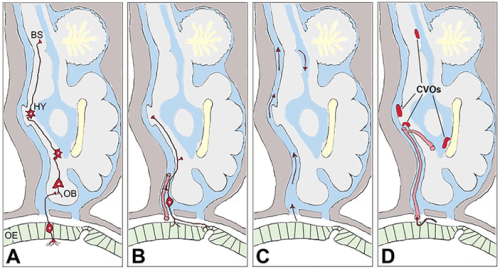
Slika 1: Štiri možne poti vstopa SARS-CoV-2 iz vohalnega epitela (OE) v možgane. A – iz vohalnega bulbusa (OB) preko vohalnega živca do hipotalamusa (HY) in možganskega debla (BS), B – preko terminalnega živca, C – preko možgansko-hrbtenjačne tekočine, D – preko krvnega ožilja. (privzeto od 41)
Vstop preko krvno-možganske prepreke. BBB je običajna vstopna točka virusov, ki se razširjajo s krvjo 33, krvni način virusne diseminacije pa je bil opažen tudi za SARS-CoV-2 42 43. Vendar prehod virusov preko BBB ni enostaven, potreben je takšen ali drugačen aktivni mehanizem internalizacije in translokacije skozi endotel možganskih žil. En način je vstop v celice BBB preko sidrnih proteinov ACE2, NRP1 in BSG (Slika 2) 48. Izražanje ACE2 v možganskih žilah je sicer bilo opaženo, vendar ni bilo pojasnjeno na celičnem nivoju 44. Vstop SARS-CoV-2 preko alternativnih sidrnih proteinov (BSG, NRP1) tudi ni izključen 31. Drug način je prehod virusa preko predhodno poškodovane oz. razrahljane BBB (Slika 2). Strukturo in stabilnost BBB porušijo citokini, kot so dejavnik tumorske nekroze (TNF) ter interlevkini IL-6 , IL-1β in IL-17 in so vsi posledica imunskega odziva akutne okužbe s SARS-CoV-2 45. Pomenljiv je zato sklep, da si SARS-CoV-2 z okužbo ostalih organov, predvsem organov dihalnega sistema, zgolj zagotovi pogoje za vstop v centralni živčni sistem in da so možgani v bistvu končni cilj virusne okužbe, ne pa zgolj vzporedno prizadet organ 46. Tretji način vstopa SARS-CoV-2 v možgane bi lahko bil preko sicer nepoškodovane BBB, a v območjih, kjer je ta že sama po sebi bolj prepustna, kot je na področju stika s hipotalamusom 47. Sicer je SARS-CoV-2 z dimenzijami 80–120 nm večji od običajnih odprtin BBB v tem predelu, se le-te občasno za kratek čas lahko povečajo, poleg tega pa naj bi kapilarne celice in tanicite (celice za komunikacijsko povezavo med CSF in hipotalamusom) izražale ACE2 in TMPRSS2, kar še dodatno omogoči vstop SARS-CoV-2 v hipotalamus 39, iz njega pa je virusu odprta pot praktično v vse predele možgan.
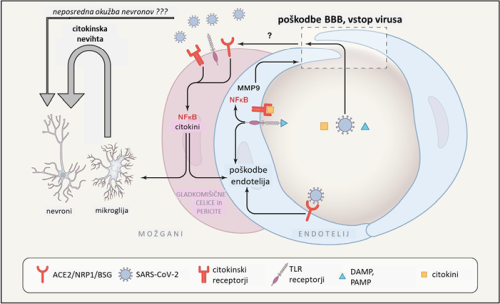
Slika 2: Shematski model poškodbe krvno-možganske prepreke (BBB) in vstopa SARS-CoV-2 v možgane. SARS-CoV-2 virioni, citokini, molekule DAMP (s poškodbami povezani molekularni vzorci) in PAMP (s patogeni povezani molekularni vzorci) prisotni v krvi sprožijo vnetje žilnega endotelija in porušitev integritete krvno-možganske prepreke. Dalje pride do vnetja notranjih žilnih celic (gladkomišične celice, pericite) in možganskih imunskih celic (mikroglija, makrofagi). Posledice vseh teh vnetnih procesov so velike količine citokinov, ki delujejo toksično na možganske celice, tudi na nevrone. Neposredna okužba nevronov s SARS-CoV-2 še ni konsistentno potrjena, nikakor pa ni izključena. (povzeto po 48)
Vstop z okuženimi imunskimi celicami. Z virusi okužene imunske celice lahko na eni strani služijo kot njihov rezervoar, po drugi strani pa so okužene imunske celice za virus idealen način njegovega razširjanja po telesu, tudi do centralnega živčnega sistema 33. Monociti, nevtrofilci in T-limfociti lahko dostopajo do centralnega živčnega sistema preko ožilja v možganih, možganskih ovojnic in horoidnega pleteža 49, ni pa še trdnih dokazov, ali jih SARS-CoV-2 sploh lahko neposredno okuži 50. Na možnost okužbe imunskih celic kažeta imunoreaktivnost na SARS-CoV-2 kapsidne proteine v CD68+ makrofagih limfnih organov 51 ter prisotnost virusne RNA v alveolarnih makrofagih 52, vendar ni jasno, ali je to posledica neposredne okužbe s SARS-CoV-2 ali fagocitnega privzema ostankov okuženih celic oziroma zunajceličnih virionov.
Zaključki in nadaljnje usmeritve
Zaključimo lahko, da so nevrološki učinki okužbe s SARS-CoV-2 precej pogosti, v kakšni obliki in v kakšnih intenzitetah se pokažejo, pa je odvisno od vsakega bolnika posebej. Pregled trenutno dostopne znanstveno-klinične literature ima to slabost, da temelji večinoma na opisih posameznih primerov (angl. Case Reports), le malo je obsežnejših in kontroliranih raziskav. Poleg tega poročila v večini zajemajo bolnike, hospitalizirane zaradi hudih respiratornih simptomov, ki predstavljajo le približno 10 odstotkov vseh obolelih. Odprta vprašanja, izziv za prihodnje raziskave, so:
Katere nevrološke posledice okužbe s SARS-CoV-2 in v kolikšni meri so posledica neposredne okužbe centralnega živčnega sistema in v kolikšni meri posledica posrednih, sistemskih dejavnikov?
Ali možgani aktivno prispevajo k stanju dereguliranega imunskega sistema ali zgolj utrpijo njegove posledice?
Ali možgani prispevajo k odpovedi dihalnega sistema ali je le-ta izključna posledica propada tkiv in organov dihalnega sistema?
In najpomembnejše vprašanje, na katerega bomo zaradi njegove narave lahko odgovorili šele čez nekaj let: Kakšne so dolgoročne nevrološke in nevropsihiatrične posledice okužbe s SARS-CoV-2?
-
___
-
Mao L, Jin H, Wang M, et al. Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurologyogy. 2020;77:1-9. ↩
-
Helms J, Kremer S, Merdji H, et al. Neurologic Features in Severe SARS-CoV-2 Infection. New England Journal of Medicine. 2020;382:2268-2270. ↩
-
Oxley TJ, Mocco J, Majidi S, et al. Large- Vessel Stroke as a Presenting Feature of Covid-19 in the Young. New England Journal of Medicine. 2020;382:e60. ↩
-
Efe IE, Aydin OU, Alabulut A, et al. COVID-19-Associated Encephalitis Mimicking Glial Tumor. World Neurosurgery. 2020;140:46-48. ↩
-
Farhadian S, Glick LR, Vogels CBF, et al. Acute Encephalopathy with Elevated CSF Inflammatory Markers as the Initial Presentation of COVID-19. BMC Neurology. 2020;20:248. ↩
-
Huang YH, Jiang D, Huang JT. SARS-CoV-2 Detected in Cerebrospinal Fluid by PCR in a Case of COVID-19 Encephalitis. Brain, Behavior, and Immunity. 2020;87:149. ↩
-
Moriguchi T, Harii N, Goto J, et al. A First Case of Meningitis/Encephalitis Associated with SARS-Coronavirus-2. International Journal of Infectious Diseases. 2020;94:55-58. ↩
-
Pilotto A, Odolini S, Masciocchi S, et al. Steroid-Responsive Encephalitis in Coronavirus Disease 2019. Annals Of Neurology. 2020;88:423-427. ↩
-
International Encephalitis Consortium: Venkatesan A, Tunkel AR, Bloch KC, et al. Case Definitions, Diagnostic Algorithms, and Priorities in Encephalitis: Consensus Statement of the International Encephalitis Consortium. Clinical Infectious Diseases. 2013;57:1114-1128. ↩
-
Rogers JP, Chesney E, Oliver D, et al. Psychiatric and Neuropsychiatric Presentations Associated with Severe Coronavirus Infections: a Systematic Review and Meta-Analysis with Comparison to the COVID-19 Pandemic. Lancet Psychiatry. 2020;7:611-627. ↩
-
Cummings MJ, Baldwin MR, Abrams D, et al. Epidemiology, Clinical Course, and Outcomes of Critically Ill Adults with COVID-19 in New York City: a Prospective Cohort Study. Lancet. 2020;395:1763-1770. ↩
-
Merkler AE, Parikh NS, Mir S, et al. Risk of Ischemic Stroke in Patients With Coronavirus Disease 2019 (COVID-19) vs Patients With Influenza. JAMA Neurology. 2020;77:1366-1372. ↩
-
Yaghi S, Ishida K, Torres J, et al. SARS-CoV-2 and Stroke in a New York Healthcare System. Stroke. 2020;51:2002-2011. ↩
-
Oxley TJ, Mocco J, Majidi S, et al. Large-Vessel Stroke as a Presenting Feature of Covid-19 in the Young. The New England Journal of Medicine. 2020;382:e60. ↩
-
Coolen T, Lolli V, Sadeghi N, et al. Early Postmortem Brain MRI Findings in COVID-19 Non-survivors. Neurology. 2020;95:e2016-e2027. ↩
-
COVID-19 Lombardy ICU Network: Grasselli G, Zangrillo A, Zanella A, et al. Baseline Characteristics and Outcomes of 1591 Patients Infected With SARS-CoV-2 Admitted to ICUs of the Lombardy Region, Italy. JAMA. 2020;323:1574-1578. ↩
-
Kantonen J, Mahzabin S, Mikko I, Mäyränpää MI, et al. Neuropathologic Features of Four Autopsied COVID-19 Patients. Brain Pathology. 2020;30:1012-1016. ↩
-
Solomon IH, Normandin E, Bhattacharyya S, et al. Neuropathological Features of Covid-19. The New England Journal of Medicine. 2020;383:989-992. ↩
-
Parsons T, Banks S, Bae C, et al. COVID-19-Associated Acute Disseminated Encephalomyelitis (ADEM). Journal of Neurology. 2020;267:2799-2802. ↩
-
Poyiadji N, Shahin G, Noujaim D, et al. COVID-19-Associated Acute Hemorrhagic Necrotizing Encephalopathy: Imaging Features. Radiology. 2020;296:e119-e120. ↩
-
Toscano G, Palmerini F, Ravaglia S, et al. Guillain-Barre´ Syndrome Associated with SARS-CoV-2. The New England Journal of Medicine. 2020;382:2574-2576. ↩
-
Gutierrez-Ortiz C, Mendez-Guerrero A, Rodrigo-Rey S. Miller-Fisher Syndrome and Polyneuritis Cranialis in COVID-19. Neurology. 2020;95:e601-e605. ↩
-
Gerges Harb J, Noureldine HA, Chedid G, et al. SARS, MERS and COVID-19: Clinical Manifestations and Organ-System Complications: a Mini Review. Pathogens and Disease. 2020;78:ftaa033. ↩
-
Surtees R, DeSousa C. Influenza Virus-Associated Encephalopathy. Archives of Disease in Childhood. 2006;91:455-456. ↩
-
CRICS TRIGGERSEP Group: Helms J, Tacquard C, Severac F., et al. High Risk of Thrombosis in Patients with Severe SARS-CoV-2 Infection: a Multicenter Prospective Cohort Study. Intensive Care Medicine. 2020;46:1089-1098. ↩
-
Paranjpe I, Fuster V, Lala A, et al. Association of Treatment Dose Anticoagulation With In-Hospital Survival Among Hospitalized Patients With COVID-19. Journal of the American College of Cardiology. 2020;76:122-124. ↩
-
Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARSCoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020;181:271-280. ↩
-
Hamming I, Timens W, Bulthuis MLC, et al. Tissue Distribution of ACE2 Protein, the Functional Receptor for SARS Coronavirus. A First Step in Understanding SARS Pathogenesis. J. Pathol. 2004;203:631-637. ↩
-
Chen R, Yu J, Wang K, et al. The Spatial and Cell-Type Distribution of SARS-CoV-2 Receptor ACE2 in Human and Mouse Brain. bioRxiv. 2020. https://doi.org/10.1101/2020.04.07.030650. ↩
-
Wang K, Chen W, Zhou Y-S, et al. SARS-CoV-2 Invades Host Cells via a Novel Route: CD147-Spike Protein. bioRxiv. 2020. https://doi.org/10.1101/2020.03.14.988345. ↩
-
Cantuti-Castelvetri L, Ojha R, Pedro LD, et al. Neuropilin-1 Facilitates SARS-CoV-2 Cell Entry and Provides a Possible Pathway into the Central Nervous System. bioRxiv. 2020. https://doi.org/10.1101/2020.06.07.137802. ↩
-
Shang J, Wan Y, Luo C, et al. Cell Entry Mechanisms of SARS-CoV-2. PNAS. 2020;117:11727-11734. ↩
-
Bergmann CC, Lane TE, Stohlman SA. Coronavirus Infection of the Central Nervous System: Host-Virus Stand-off. Nature Reviews Microbiology. 2006;4:121-132. ↩
-
Song E, Zhang C, Israelow B, et al. Neuroinvasive Potential of SARS-CoV-2 Revealed in a Human Brain Organoid Model. bioRxiv. 2020. https://doi.org/10.1101/2020.06.25.169946. ↩
-
Yang L, Han Y, Nilsson-Payant BE, et al. A Human Pluripotent Stem Cell-based Platform to Study SARS-CoV-2 Tropism and Model Virus Infection in Human Cells and Organoids. Cell Stem Cell. 2020;27:125-136. ↩
-
Politi LS, Salsano E, Grimaldi M. Magnetic Resonance Imaging Alteration of the Brain in a Patient With Coronavirus Disease 2019 (COVID-19) and Anosmia. JAMA Neurology. 2020;77:1028-1029. ↩
-
Dubé M, Le Coupanec A, Wong AHM, et al. Axonal Transport Enables Neuron-to-Neuron Propagation of Human Coronavirus OC43. Journal of Virology. 2018;92:e00404-18. ↩
-
Butowt R, von Bartheld CS. Anosmia in COVID-19: Underlying Mechanisms and Assessment of an Olfactory Route to Brain Infection. The Neuroscientist. 2020; https://doi.org/10.1177/1073858420956905. ↩
-
Brann DH, Tsukahara T, Weinreb C, et al. Non-Neuronal Expression of SARS-CoV-2 Entry Genes in the Olfactory System Suggests Mechanisms Underlying COVID-19-Associated Anosmia. Science Advances. 2020;382:eabc5801. ↩
-
Nampoothiri S, Sauve F, Ternier G, et al. The Hypothalamus as a Hub for SARS-CoV-2 Brain Infection and Pathogenesis. bioRxiv. 2020. https://doi.org/10.1101/2020.06.08.139329. ↩
-
Lochhead JJ, Thorne RG. Intranasal Delivery of Biologics to the Central Nervous System. Advanced Drug Delivery Reviews. 2012;64:614-628. ↩
-
Wang W, Xu Y, Gao R, et al. Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA. 2020;323:1843-1844. ↩
-
Zheng S, Fan J, Yu F, et al. Viral Load Dynamics and Disease Severity in Patients Infected with SARS-CoV-2 in Zhejiang Province, China, January-March 2020: Retrospective Cohort Study. BMJ. 2020;369:m1443. ↩
-
Iadecola C, Anrather J, Kamel H. Effects of COVID-19 on the Nervous System. Cell. 2020;183:16-27. ↩
-
Bryce C, Grimes Z, Pujadas E, et al. Pathophysiology of SARS-CoV-2: Targeting of Endothelial Cells Renders a Complex Disease with Thrombotic Microangiopathy and Aberrant Immune Response. The Mount Sinai COVID-19 Autopsy Experience. medRxiv. 2020. https://doi.org/10.1101/2020.05.18.20099960. ↩
-
Erickson MA, Banks WA. Neuroimmune Axes of the Blood-Brain Barriers and Blood-Brain Interfaces: Bases for Physiological Regulation, Disease States, and Pharmacological Interventions. Pharmacological Reviews. 2018;70:278-314. ↩
-
Franca R A, Ugga L, Guadagno E, et al. Neuroinvasive Potential of SARS-CoV-2 with Neuroradiological and Neuropathological Findings: Is the Brain a Target or a Victim? Journal of Pathology, Microbiology and Immunology. 2021;129:37-54. ↩
-
Kaur C, Ling E-A The circumventricular organs. Histology and Histopathology. 2017;32:879-892. ↩
-
Engelhardt B, Vajkoczy P, Weller RO. The Movers and Shapers in Immune Privilege of the CNS. Nature Immunology. 2017;18:123-131. ↩
-
Merad M, Martin JC. Pathological Inflammation in Patients with COVID-19: A Key role for Monocytes and Macrophages. Nature Reviews Immunology. 2020;20:355-362. ↩
-
Chen Y, Feng Z, Diao B, et al. The Novel Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Directly Decimates Human Spleens and Lymph Nodes. MedRxiv. 2020. https://doi.org/10.1101/2020.03.27.20045427. ↩
-
Bost P, Giladi A, Liu Y, et al. Host-Viral Infection Maps Reveal Signatures of Severe COVID-19 Patients. Cell 2020;181: 1475-1488. ↩
DDr. Matjaž Deželak, univ. dipl. biol.
SiNAPSA, slovensko društvo za nevroznanost