Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Bomo lahko odslej nevrodegenerativne bolezni zdravili z matičnimi celicami?
članki
eSinapsa, 2011-1
Zvezdan Pirtošek
Eksoskeleti – inteligentne bionske naprave
Marko Munih
O aktualnih dilemah draženja globokih možganskih struktur pri obsesivno - kompulzivni motnji
Nadja Jarc
Sledite svojo srečo ... z iPhone
Urban Kordeš
eSinapsa, 2011-2
Renata Salecl
Gašper Tkačik
Astrociti – spregledane zvezde nevrobiologije
Marko Kreft, Robert Zorec
Sašo Dolenc
Meditacija - malo truda, veliko koristi
Luka Dimic
eSinapsa, 2011-3
Mara Bresjanac
Martina Starc
Rok Berlot
Varnost uporabe generičnih protiepileptičnih zdravil
Mojca Kržan, Matevž Kržan
Možgani, računalniki - nekaj vmes
Miha Pelko
eSinapsa, 2012-4
Ali so moški in ženski možgani različni?
Gregor Majdič
O kognitivnih motnjah pri bolnikih s Parkinsonovo boleznijo
Dejan Georgiev
Akutno možgansko kap lahko uspešno zdravimo
Nina Vujasinovič, Bojana Žvan
Vloga nevropsihološke diagnostike pri odkrivanju zgodnjih znakov alzheimerjeve bolezni
Simon Brezovar
eSinapsa, 2013-5
Novo odkritje na področju sporadičnih prionskih bolezni
Jana Jerše, Nadja Jarc
Učinek placeba brez lažnih zdravil in zavajanja
Mara Bresjanac
Subarahnoidna krvavitev zaradi tromboze venskih sinusov
Mateja Repar, Anita Resman Gašperčič
Srečanje dveh velikanov: možganov in imunskega sistema
Matej Markota
eSinapsa, 2013-6
Odstranjevanje možganskih tumorjev pri budnem bolniku
Andrej Vranič, Jasmina Markovič, Blaž Koritnik
Zmedena bolnica, ki nič ne vidi ali PRES
Manja Hribar, Vid Zgonc
Manja Hribar
Netravmatska lokalizirana konveksitetna subarahnoidna krvavitev
Mateja Repar, Fajko F. Bajrović
Sistemska skleroza in ishemična možganska kap - vzročna povezanost ali le koincidenca?
Mateja Repar, Janja Pretnar Oblak
Klemen Grabljevec
Z omejevanjem spodbujajoča terapija pri bolnikih po nezgodni možganski poškodbi
Dejana Zajc, Klemen Grabljevec
eSinapsa, 2014-7
Možgani v mreži navezanosti, ki nas zaznamuje
Barbara Horvat
Vpliv senzoričnega dotoka na uglasitev možganskih povezav
Peter Gradišnik
Človeški konektom ali kakšne so zveze v naših možganih
Blaž Koritnik
Niko Lah
Torkove delavnice za osnovnošolce
Mateja Drolec Novak, Vid V. Vodušek
Da ne pozabim! Tehnike za pomladitev spomina
Klara Tostovršnik, Hana Hawlina
Površina socialne nevroznanosti
Manuel Kuran
Clarity - bistri možgani Karla Deisserotha
Gregor Belušič
Barbara Gnidovec Stražišar
Bojana Žvan
Nevroplastičnost po možganski kapi
Marjan Zaletel
Klinično psihološka obravnava pacientov po možganski kapi in podpora pri vračanju na delovno mesto
Barbara Starovasnik Žagavec
Možgani: organ, s katerim ljubimo
Andraž Matkovič
Marija Šoštarič Podlesnik
Gibalno-kognitivna vadba: praktična delavnica
Mitja Gerževič, Marina Dobnik
Anton Grad
Nevrologija, imunologija, psihiatrija …
Bojan Rojc
Andraž Stožer, Janez Bregant
Dominika Novak Pihler
Možganska kap – »kako ostati v omrežju?«
Nina Ozimic
Klara Tostovršnik
eSinapsa, 2014-8
Znotrajžilno zdravljenje možganskih anevrizem
Tamara Gorjanc, Dimitrij Lovrič
Obravnava hladnih možganskih anevrizem
Bojana Žvan, Janja Pretnar Oblak
Ali deklice z Rettovim sindromom govorijo z očmi?
Anka Slana, Urška Slana
Progresivna multifokalna encefalopatija
Urša Zabret, Katarina Šurlan Popovič
Ne ubijaj – poskusi na živalih
Martina Perše
Poizkusi na živalih - za in proti
Simon Horvat
eSinapsa, 2015-9
Kako deluje navigacijski sistem v naših možganih
Simon Brezovar
Vsakodnevno delo slepe osebe / s slepo osebo
Denis Kamnar
Uroš Marušič
Manca Tekavčič Pompe
Toni Pustovrh
Marko Hawlina
Od svetlobe do podobe ali kako vidijo svet naši možgani
Simon Brezovar
Janja Hrastovšek
Zala Kurinčič
Pogledi na mejno osebnostno motnjo
Jerica Radež, Peter Kapš
Uvid kot socialno psihološki fenomen
Vid Vodušek
Uvod v vidno-prostorske funkcije s praktičnimi primeri
Ana Bujišić, Sanja Roškar
eSinapsa, 2015-10
Difuzijsko magnetnoresonančno slikanje
Rok Berlot
Katja Pavšič
Radiološko izolirani sindrom - ali ga moramo poznati?
Matej Vouk, Katarina Šurlan Popovič
Kako izgledajo možgani, ki govorijo več jezikov?
Gašper Zupan
Nov pristop v rehabilitaciji - terapija s pomočjo psa
Mateja Drljepan
Pogled v maternico z magnetnoresonančno preiskavo
Taja Jordan, Tina Vipotnik Vesnaver
Saša Zorjan
Saša Zorjan
Nevroestetika: ko nevroznanost obišče galerijo
Anja Voljavec, Hana Hawlina, Nika Vrabič
Ali so psihogeni neepileptični napadi res psihogeni?
Saška Vipotnik, Gal Granda
Kako nam lahko glasna glasba »vzame« sluh in povzroči tinitus
Nejc Steiner, Saba Battelino
eSinapsa, 2016-11
Mara Bresjanac
Kako ultrazvok odpira pot v možgane
Kaja Kolmančič
Kako je epigenetika spremenila nevroznanost
Metka Ravnik Glavač
Ondinino prekletstvo ali sindrom prirojene centralne hipoventilacije
Katja Pavšič, Barbara Gnidovec Stražišar, Janja Pretnar Oblak, Fajko F. Bajrović
Zika virus in magnetnoresonančna diagnostika nepravilnosti osrednjega živčevja pri plodu
Rok Banko, Tina Vipotnik Vesnaver
Motnje ravnotežja otrok in odraslih
Nejc Steiner, Saba Battelino
eSinapsa, 2016-12
Vloga magnetnoresonančne spektroskopije pri obravnavi možganskih tumorjev
Gašper Zupan, Katarina Šurlan Popovič
Tiskanje tridimenzionalnih modelov v medicini
Andrej Vovk
Aleš Oblak
Kevin Klarič
Sinestezija: umetnica, ki ne želi odrasti
Tisa Frelih
Računska psihiatrija: od nevroznanosti do klinike
Nastja Tomat
Kognitivni nadzor: od vsakdanjega življenja do bolezni
Vida Ana Politakis
eSinapsa, 2017-13
Internet: nadgradnja ali nadomestek uma?
Matej Perovnik
Vloga črevesnega mikrobioma pri odzivu na stres
Vesna van Midden
Stres pušča posledice tako na človeškem kot živalskem organizmu
Jasmina Kerčmar
Prikaz normalne anatomije in bolezenskih stanj obraznega živca z magnetno resonanco
Rok Banko, Matej Vrabec
Psihedelična izkušnja in njen zdravilni potencial
Anja Cehnar, Jona Basle
Vpliv hiperglikemije na delovanje možganov
Jasna Šuput Omladič, Simona Klemenčič
Nevrofibromatoza: napredujoče obolenje centralnega in perifernega živčevja
Nejc Steiner, Saba Battelino
Fenomen žrtvenega jagnja v dobi interneta
Dolores Trol
Tesnoba staršev in strategije spoprijemanja, ko pri otroku na novo odkrijejo epilepsijo
Daša Kocjančič, Petra Lešnik Musek, Vesna Krkoč, David Gosar
eSinapsa, 2017-14
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
eSinapsa, 2018-15
Susceptibilno poudarjeno magnetnoresonančno slikanje pri bolniku z ALS
Alja Vičič, Jernej Avsenik, Rok Berlot
Sara Fabjan
Reverzibilni cerebralni vazokonstrikcijski sindrom – pot do diagnoze
Maja Cimperšek, Katarina Šurlan Popovič
Liam Korošec Hudnik
Kognitivno funkcioniranje pri izgorelosti
Marina Horvat
eSinapsa, 2019-16
Maša Čater
Saša Koprivec
Infekcije osrednjega živčnega sistema s flavivirusi
Maja Potokar
Raziskava: Kako depresija vpliva na kognitivne sposobnosti?
Vida Ana Politakis
Razvoj depresije pri otrocih z vidika navezovalnega vedenja
Neža Grgurevič
Sonja Prpar Mihevc
Umetno inteligentna nevroznanost: srečanje nevronskih mrež in možganske fiziologije
Kristijan Armeni
Čebelji strup pri preventivi nevrodegenerativnih bolezni in priložnost za klinično prakso
Matjaž Deželak
eSinapsa, 2019-17
IgG4+ – skupni imenovalec diagnoz iz preteklosti
Cene Jerele, Katarina Šurlan Popovič
Nov molekulski mehanizem delovanja ketamina v astrocitih
Matjaž Stenovec
Praktični pristop k obravnavi utrujenosti in motenj spanja pri bolnikih z multiplo sklerozo
Nik Krajnc, Leja Dolenc Grošelj
Jure Pešak
eSinapsa, 2020-18
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
eSinapsa, 2020-19
Ob mednarodnem dnevu znakovnih jezikov
Anka Slana Ozimič
Teorija obetov: kako sprejemamo tvegane odločitve
Nastja Tomat
Sara Fabjan
Matjaž Deželak
Nina Stanojević, Uroš Kovačič
Od človeških nevronov do možganskih organoidov – nova obzorja v nevroznanosti
Vesna M. van Midden
Splošna umetna inteligenca ali statistične jezikovne papige?
Kristijan Armeni
Zunajcelični vezikli kot prenašalci zdravilnih učinkovin preko krvno-možganske prepreke
Saša Koprivec
Matjaž Deželak
eSinapsa, 2021-20
Migrena: starodavna bolezen, sodobni pristopi k zdravljenju
Eva Koban, Lina Savšek
Zgodnji razvoj socialnega vedenja
Vesna Jug
Nastja Tomat
Mikrosplet: povezovanje preko mikrobioma
Tina Tinkara Peternelj
Stimulacija možganov kot način zdravljenja depresije
Saša Kocijančič Azzaoui
eSinapsa, 2021-21
eSinapsa, 2022-22
Sodobni vidiki motenj hranjenja
Karin Sernec
Ples in gibalni dialog z malčki
Neva Kralj
Atul Gawande
Jezikovna funkcija pri Alzheimerjevi bolezni
Gašper Tonin
Dostava terapevtikov preko krvno-možganske pregrade
Matjaž Deželak
eSinapsa, 2022-23
Akutni ishemični infarkt hrbtenjače pri zdravih otrocih – kaj lahko pove radiolog?
Katarina Šurlan Popovič, Barbara Šijaković
eSinapsa, 2023-24
Možganska omrežja pri nevrodegenerativnih boleznih
Tomaž Rus, Matej Perovnik
Morske živali kot navdih za nevroznanstvenike: morski konjiček, morski zajček in klobučnjak
Tina Bregant
Metoda Feldenkrais: gibanje in nevroplastičnost
Mateja Pate
Etično naravnana animalna nevroznanost
Maša Čater
Helena Motaln, Boris Rogelj
eSinapsa, 2023-25
Urban Košak, Damijan Knez, Anže Meden, Simon Žakelj, Jurij Trontelj, Jure Stojan, Maja Zakošek Pipan, Kinga Sałat idr.
Dandanes so nevrodegenerativne bolezni svetovni problem. Najpogostejše med njimi so multipla skleroza, Alzheimerjeva bolezen, Parkinsonova bolezen, demenca in Huntingtonova bolezen. Navadno jih diagnosticiramo pri starejših ljudeh, nekatere pa so značilne tudi za mlajše generacije med 20. in 40. letom. Pojavljati se začnejo simptomi, kot so slabše pomnjenje, motnje v razmišljanju in koncentraciji ter slabšanje motorike. Vzrok tiči v poškodbah nevronov in/ali mielinskega ovoja. Sodobne terapije so namenjene predvsem blaženju simptomov, ne omogočajo pa zajezitve širjenja bolezni, regeneracije tkiv in ozdravitve. Vsled temu so danes v razmahu raziskave z matičnimi celicami, ki predstavljajo izjemen potencial za zdravljenje nevrodegenerativnih bolezni in regeneracijo tkiva.
Mielinska ovojnica je močno raztegnjena in preoblikovana membrana plazme, ki kot spirala obdaja živčni akson 1. Izločajo jo Schwannove celice perifernega živčnega sistema in oligodendrociti centralnega živčnega sistema. Te celice proizvajajo mielin, ki obdaja posamezne dele aksonov, med katerimi ostajajo krajši nepokriti predeli, imenovani Ranvierjevi vozlji, ki so pomembni za samo delovanje mielina. Mielin deluje kot električni izolator in omogoča boljšo prevodnost aksonov. Izboljša hitrost prevajanja signalov in to omogoča z aksoni veliko manjših premerov ter pri tem porabi precej manj energije kot nemieliniziran akson. Prenos signalov po nemieliziranih aksonih je mnogo počasnejši kot po mieliziranih. Za boljšo predstavo je zanimiva primerjava učinkovitosti v naslednjem primeru. Nemieliziran akson lignja ima premer kar 500 µm in za prenos signala potrebuje 5000-krat več energije in zavzame 1500-krat več prostora kot mieliniziran živec žabe s premerom 0,012 µm 2. Če bi pri človeku z živci brez mielinskega ovoja želeli ohraniti enako hitrost prevodnosti, kot jo imamo z mielinsko ovojnico, bi potrebovali hrbtenjačo v velikosti in dolžini debla konkretnega drevesa 3.
Bolezni, ki vključujejo demielinizacijo nevronov, kot sta levkodistrofija in multipla skleroza, spadajo med nevrodegenerativne bolezni, za katere je značilna napredujoča izguba mielina, ki vodi v kronično demielinizirano stanje, nepravilno hitrost prevodnosti aksonov ter nevrološke patologije (Slika 1)7.
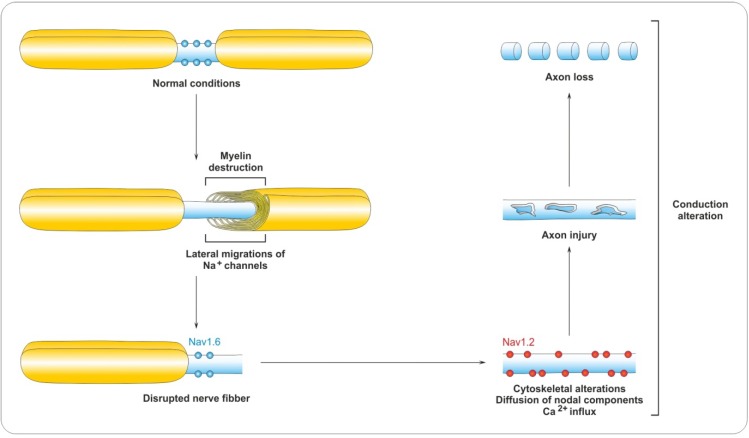
Slika 1: Prikaz napredovanja nevrodegenerativne bolezni z izgubo mielinske ovojnice in posledično tudi aksonov.7
Oligodendrociti vzdržujejo metabolizem aksonov kot tudi pravilen prenos živčnih impulzov, zato njihova izguba vodi v nevrodegeneracijo 4. Multiplo sklerozo delimo na dve fazi: akutno in kronično. Za akutno fazo je značilno, da progenitorne celice oligodendrocitov, ki se nahajajo v celotnem možganskem parenhimu, zavzamejo lezijo, remielinizirajo poškodovane aksone in jih s tem obnovijo. Pri kronični fazi pa se začnejo pojavljati simptomi slabše migracije celic in oslabljene sposobnosti diferenciacije. Posledica je dolgotrajna in napredujoča demielinizacija. Že pred nekaj leti so španski raziskovalci odkrili, da je z uporabo mezenhimskih matičnih celic iz kostnega mozga možno aktivirati progenitorne celice oligodendrocitov in s tem pospešiti remielinizacijo 5. Podobno so poročali tudi v mnogih drugih znanstvenih objavah, vendar so spremembe v večini opažali le na lokalni ravni, kamor so matične celice vbrizgali. Tako je več let ta težava predstavljala izziv za celične terapije v razvoju, saj so raziskovalci želeli učinek na globalnem nivoju in funkcionalno remielinizacijo v več možganskih delih, kjer pride do izgube mielina.
Španski raziskovalci so leta 2016 v reviji Cell Death and Disease, ki izhaja pod okriljem založniške skupine Nature, objavili izjemen dosežek s področja regeneracije mielina s celično terapijo 6. Uporabili so miši s kronično demieliniziranimi nevroni ter matične celice iz kostnega mozga, ki so jih injicirali v možgane, natančneje v tretja ventrikla. Po treh mesecih so z magnetno resonanco ugotovili, da so vbrizgane matične celice še vedno prisotne v tretjih ventriklih, pa tudi v lateralnih ventriklih, ne pa tudi drugod v možganih. Gostota mielina je bila močno povečana v delu možganov, ki ga imenujemo corpus callosum, v primerjavi z istimi mišmi v času pred celično terapijo in kontrolnimi mišmi. Corpus callosum je del možganov, ki je najbolj podvržen nevrodegenerativnim boleznim, kot je multipla skleroza. V tem predelu možganov so že dva meseca po celični terapiji odkrili močno povečano število progenitornih celic oligodendrocitov, po treh mesecih pa tudi odrasle oligodendrocite. Raziskovalci stremijo k razlagi, da gre za parakrinski učinek številnih trofičnih dejavnikov. Injicirane matične celice naj bi izločale trofične dejavnike, ki nato stimulirajo diferenciacijo progenitornih celic živčnih celic v subventrikularni coni možganov v progenitorne celice oligodendrocitov in njihovo migracijo proti corpus callosum, tam pa se dokončno diferencirajo v oligodendrocite (Slika 2).
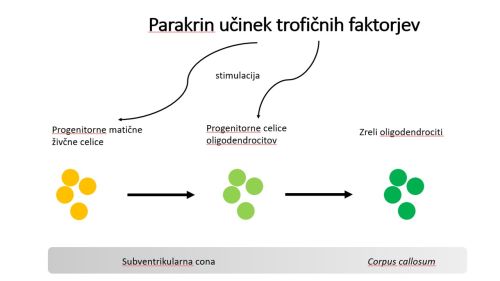
Slika 2: Shematična predstavitev, kako presajene matične celice preko trofičnih dejavnikov vplivajo na oblikovanje oligodendrocitov v možganih.
Poleg tega naj bi trofični dejavniki stimulirali tudi že obstoječe parenhimske progenitorne celice oligodendrocitov v bližnjih predelih možganov. Funkcionalno regeneracijo mielina so potrdili z elektrofiziološkimi testi, kjer so opazili povečano hitrost prevodnosti aksonov v corpus callosum ter povečano debelino mielina pri tretiranih miših. Raziskava predstavlja izjemen dosežek na področju celične terapije nevrodegenerativnih bolezni, saj so raziskovalci prav z izbiro ventriklov kot mestom injiciranja matičnih celic uspeli vzbuditi parakrin učinek in aktivirati mielinizacijo tudi v drugih delih možganov, ne le lokalno na mestu injiciranja celic. Rezultati študije predstavljajo velik potencial za razvoj novih celičnih terapij v boju z nevrodegenerativnimi boleznimi, saj kažejo, da sta oligodendrogeneza in funkcionalna remielinizacija s pomočjo matičnih celic pravzaprav mogoči.
-
___
-
Raine, C. S. 1984. Morphology of myelin and myelination. V: Myelin (Morell P., ur.), 2. izdaja. New York, Plenum: 1-41. ↩
-
Morell P., Quarles R. H. 1999. The Myelin Sheath. V: Basic Neurochemistry: Molecular, Cellular and Medical Aspects (Siegel G. J. et al., ur), 6. izdaja. Philadelphia, Lippincott-Raven. ↩
-
Ritchie J. M. 1984. Physiological basis of conduction in myelinated nerve fibers. V: Myelin (Morell P., ur.), 2. izdaja. New York, Plenum: 117-141. ↩
-
Podbielska M., Banik N. L., Kurowska E., Hogan E. L. 2013. Myelin recovery in multiple sclerosis: the challenge of remyelination. Brain Sciences, 3 (3): 1282-1324. ↩
-
Trapp B. D., Nave K. A. 2008. Multiple sclerosis: an immune or neurodegenerative disorder? Annual Reviews in Neuroscience, 31: 247-269 ↩
-
Jaramillo-Merchan J., Jones J., Ivorra J. L., Pastor D., Viso-Leon M. C., Armengol J. A., Molto M. D., Geijo-Barrientos E., Martinez S. 2013. Mesenchymal stromal-cell transplants induce oligodendrocyte progenitor migration and remyelination in a chronic demyelination model. Cell Death and Disease, 4: e779, doi:10.1038/cddis.2013.304 ↩
-
Cruz-Martinez P., Gonzalez-Granero S., Molina-Navarro M. M., Pacheco-Torres J., Garcia-Verdugo J. M., Geijo-Barrientos E., Jones J., Martinez S. 2016. Intraventricular injections of mesenchymal stem cells activate endogenous functional remyelination in a chronic demyelinating murine model. Cell Death and Disease, 7, e2223, doi: 10.1038/cddis.2016.130 ↩
dr. Maša Čater, univ. dipl. bioteh.
Laboratorij za genomiko živali
Inštitut za predklinične vede
Veterinarska fakulteta
Univerza v Ljubljani