Spletna revija za znanstvenike, strokovnjake
in nevroznanstvene navdušence
Naslovnica Članki Intervjuji Mnenja Zdravje Korenine eSinapsa Številke ![]()
Mejna osebnostna motnja – okoljski in genetski temelji nevroloških implikacij
članki
eSinapsa, 2011-1
Zvezdan Pirtošek
Eksoskeleti – inteligentne bionske naprave
Marko Munih
O aktualnih dilemah draženja globokih možganskih struktur pri obsesivno - kompulzivni motnji
Nadja Jarc
Sledite svojo srečo ... z iPhone
Urban Kordeš
eSinapsa, 2011-2
Renata Salecl
Gašper Tkačik
Astrociti – spregledane zvezde nevrobiologije
Marko Kreft, Robert Zorec
Sašo Dolenc
Meditacija - malo truda, veliko koristi
Luka Dimic
eSinapsa, 2011-3
Mara Bresjanac
Martina Starc
Rok Berlot
Varnost uporabe generičnih protiepileptičnih zdravil
Mojca Kržan, Matevž Kržan
Možgani, računalniki - nekaj vmes
Miha Pelko
eSinapsa, 2012-4
Ali so moški in ženski možgani različni?
Gregor Majdič
O kognitivnih motnjah pri bolnikih s Parkinsonovo boleznijo
Dejan Georgiev
Akutno možgansko kap lahko uspešno zdravimo
Nina Vujasinovič, Bojana Žvan
Vloga nevropsihološke diagnostike pri odkrivanju zgodnjih znakov alzheimerjeve bolezni
Simon Brezovar
eSinapsa, 2013-5
Novo odkritje na področju sporadičnih prionskih bolezni
Jana Jerše, Nadja Jarc
Učinek placeba brez lažnih zdravil in zavajanja
Mara Bresjanac
Subarahnoidna krvavitev zaradi tromboze venskih sinusov
Mateja Repar, Anita Resman Gašperčič
Srečanje dveh velikanov: možganov in imunskega sistema
Matej Markota
eSinapsa, 2013-6
Odstranjevanje možganskih tumorjev pri budnem bolniku
Andrej Vranič, Jasmina Markovič, Blaž Koritnik
Zmedena bolnica, ki nič ne vidi ali PRES
Manja Hribar, Vid Zgonc
Manja Hribar
Netravmatska lokalizirana konveksitetna subarahnoidna krvavitev
Mateja Repar, Fajko F. Bajrović
Sistemska skleroza in ishemična možganska kap - vzročna povezanost ali le koincidenca?
Mateja Repar, Janja Pretnar Oblak
Klemen Grabljevec
Z omejevanjem spodbujajoča terapija pri bolnikih po nezgodni možganski poškodbi
Dejana Zajc, Klemen Grabljevec
eSinapsa, 2014-7
Možgani v mreži navezanosti, ki nas zaznamuje
Barbara Horvat
Vpliv senzoričnega dotoka na uglasitev možganskih povezav
Peter Gradišnik
Človeški konektom ali kakšne so zveze v naših možganih
Blaž Koritnik
Niko Lah
Torkove delavnice za osnovnošolce
Mateja Drolec Novak, Vid V. Vodušek
Da ne pozabim! Tehnike za pomladitev spomina
Klara Tostovršnik, Hana Hawlina
Površina socialne nevroznanosti
Manuel Kuran
Clarity - bistri možgani Karla Deisserotha
Gregor Belušič
Barbara Gnidovec Stražišar
Bojana Žvan
Nevroplastičnost po možganski kapi
Marjan Zaletel
Klinično psihološka obravnava pacientov po možganski kapi in podpora pri vračanju na delovno mesto
Barbara Starovasnik Žagavec
Možgani: organ, s katerim ljubimo
Andraž Matkovič
Marija Šoštarič Podlesnik
Gibalno-kognitivna vadba: praktična delavnica
Mitja Gerževič, Marina Dobnik
Anton Grad
Nevrologija, imunologija, psihiatrija …
Bojan Rojc
Andraž Stožer, Janez Bregant
Dominika Novak Pihler
Možganska kap – »kako ostati v omrežju?«
Nina Ozimic
Klara Tostovršnik
eSinapsa, 2014-8
Znotrajžilno zdravljenje možganskih anevrizem
Tamara Gorjanc, Dimitrij Lovrič
Obravnava hladnih možganskih anevrizem
Bojana Žvan, Janja Pretnar Oblak
Ali deklice z Rettovim sindromom govorijo z očmi?
Anka Slana, Urška Slana
Progresivna multifokalna encefalopatija
Urša Zabret, Katarina Šurlan Popovič
Ne ubijaj – poskusi na živalih
Martina Perše
Poizkusi na živalih - za in proti
Simon Horvat
eSinapsa, 2015-9
Kako deluje navigacijski sistem v naših možganih
Simon Brezovar
Vsakodnevno delo slepe osebe / s slepo osebo
Denis Kamnar
Uroš Marušič
Manca Tekavčič Pompe
Toni Pustovrh
Marko Hawlina
Od svetlobe do podobe ali kako vidijo svet naši možgani
Simon Brezovar
Janja Hrastovšek
Zala Kurinčič
Pogledi na mejno osebnostno motnjo
Jerica Radež, Peter Kapš
Uvid kot socialno psihološki fenomen
Vid Vodušek
Uvod v vidno-prostorske funkcije s praktičnimi primeri
Ana Bujišić, Sanja Roškar
eSinapsa, 2015-10
Difuzijsko magnetnoresonančno slikanje
Rok Berlot
Katja Pavšič
Radiološko izolirani sindrom - ali ga moramo poznati?
Matej Vouk, Katarina Šurlan Popovič
Kako izgledajo možgani, ki govorijo več jezikov?
Gašper Zupan
Nov pristop v rehabilitaciji - terapija s pomočjo psa
Mateja Drljepan
Pogled v maternico z magnetnoresonančno preiskavo
Taja Jordan, Tina Vipotnik Vesnaver
Saša Zorjan
Saša Zorjan
Nevroestetika: ko nevroznanost obišče galerijo
Anja Voljavec, Hana Hawlina, Nika Vrabič
Ali so psihogeni neepileptični napadi res psihogeni?
Saška Vipotnik, Gal Granda
Kako nam lahko glasna glasba »vzame« sluh in povzroči tinitus
Nejc Steiner, Saba Battelino
eSinapsa, 2016-11
Mara Bresjanac
Kako ultrazvok odpira pot v možgane
Kaja Kolmančič
Kako je epigenetika spremenila nevroznanost
Metka Ravnik Glavač
Ondinino prekletstvo ali sindrom prirojene centralne hipoventilacije
Katja Pavšič, Barbara Gnidovec Stražišar, Janja Pretnar Oblak, Fajko F. Bajrović
Zika virus in magnetnoresonančna diagnostika nepravilnosti osrednjega živčevja pri plodu
Rok Banko, Tina Vipotnik Vesnaver
Motnje ravnotežja otrok in odraslih
Nejc Steiner, Saba Battelino
eSinapsa, 2016-12
Vloga magnetnoresonančne spektroskopije pri obravnavi možganskih tumorjev
Gašper Zupan, Katarina Šurlan Popovič
Tiskanje tridimenzionalnih modelov v medicini
Andrej Vovk
Aleš Oblak
Kevin Klarič
Sinestezija: umetnica, ki ne želi odrasti
Tisa Frelih
Računska psihiatrija: od nevroznanosti do klinike
Nastja Tomat
Kognitivni nadzor: od vsakdanjega življenja do bolezni
Vida Ana Politakis
eSinapsa, 2017-13
Internet: nadgradnja ali nadomestek uma?
Matej Perovnik
Vloga črevesnega mikrobioma pri odzivu na stres
Vesna van Midden
Stres pušča posledice tako na človeškem kot živalskem organizmu
Jasmina Kerčmar
Prikaz normalne anatomije in bolezenskih stanj obraznega živca z magnetno resonanco
Rok Banko, Matej Vrabec
Psihedelična izkušnja in njen zdravilni potencial
Anja Cehnar, Jona Basle
Vpliv hiperglikemije na delovanje možganov
Jasna Šuput Omladič, Simona Klemenčič
Nevrofibromatoza: napredujoče obolenje centralnega in perifernega živčevja
Nejc Steiner, Saba Battelino
Fenomen žrtvenega jagnja v dobi interneta
Dolores Trol
Tesnoba staršev in strategije spoprijemanja, ko pri otroku na novo odkrijejo epilepsijo
Daša Kocjančič, Petra Lešnik Musek, Vesna Krkoč, David Gosar
eSinapsa, 2017-14
Zakaj ne zapeljem s ceste, ko kihnem?
Anka Slana Ozimič, Grega Repovš
Nobelova nagrada za odkritje molekularnih mehanizmov nadzora cirkadianih ritmov
Leja Dolenc Grošelj
Možgani pod stresom: od celic do duševnih motenj
Nastja Tomat
Na sledi prvi vzročni terapiji Huntingtonove bolezni
Danaja Metul
Razlike med spoloma pri Parkinsonovi bolezni
Kaja Kolmančič
eSinapsa, 2018-15
Susceptibilno poudarjeno magnetnoresonančno slikanje pri bolniku z ALS
Alja Vičič, Jernej Avsenik, Rok Berlot
Sara Fabjan
Reverzibilni cerebralni vazokonstrikcijski sindrom – pot do diagnoze
Maja Cimperšek, Katarina Šurlan Popovič
Liam Korošec Hudnik
Kognitivno funkcioniranje pri izgorelosti
Marina Horvat
eSinapsa, 2019-16
Maša Čater
Saša Koprivec
Infekcije osrednjega živčnega sistema s flavivirusi
Maja Potokar
Raziskava: Kako depresija vpliva na kognitivne sposobnosti?
Vida Ana Politakis
Razvoj depresije pri otrocih z vidika navezovalnega vedenja
Neža Grgurevič
Sonja Prpar Mihevc
Umetno inteligentna nevroznanost: srečanje nevronskih mrež in možganske fiziologije
Kristijan Armeni
Čebelji strup pri preventivi nevrodegenerativnih bolezni in priložnost za klinično prakso
Matjaž Deželak
eSinapsa, 2019-17
IgG4+ – skupni imenovalec diagnoz iz preteklosti
Cene Jerele, Katarina Šurlan Popovič
Nov molekulski mehanizem delovanja ketamina v astrocitih
Matjaž Stenovec
Praktični pristop k obravnavi utrujenosti in motenj spanja pri bolnikih z multiplo sklerozo
Nik Krajnc, Leja Dolenc Grošelj
Jure Pešak
eSinapsa, 2020-18
Bolezni spektra anti-MOG pri odraslih
Nik Krajnc
Samomor pod lupo nevroznanosti
Alina Holnthaner
eSinapsa, 2020-19
Ob mednarodnem dnevu znakovnih jezikov
Anka Slana Ozimič
Teorija obetov: kako sprejemamo tvegane odločitve
Nastja Tomat
Sara Fabjan
Matjaž Deželak
Nina Stanojević, Uroš Kovačič
Od človeških nevronov do možganskih organoidov – nova obzorja v nevroznanosti
Vesna M. van Midden
Splošna umetna inteligenca ali statistične jezikovne papige?
Kristijan Armeni
Zunajcelični vezikli kot prenašalci zdravilnih učinkovin preko krvno-možganske prepreke
Saša Koprivec
Matjaž Deželak
eSinapsa, 2021-20
Migrena: starodavna bolezen, sodobni pristopi k zdravljenju
Eva Koban, Lina Savšek
Zgodnji razvoj socialnega vedenja
Vesna Jug
Nastja Tomat
Mikrosplet: povezovanje preko mikrobioma
Tina Tinkara Peternelj
Stimulacija možganov kot način zdravljenja depresije
Saša Kocijančič Azzaoui
eSinapsa, 2021-21
eSinapsa, 2022-22
Sodobni vidiki motenj hranjenja
Karin Sernec
Ples in gibalni dialog z malčki
Neva Kralj
Atul Gawande
Jezikovna funkcija pri Alzheimerjevi bolezni
Gašper Tonin
Dostava terapevtikov preko krvno-možganske pregrade
Matjaž Deželak
eSinapsa, 2022-23
Akutni ishemični infarkt hrbtenjače pri zdravih otrocih – kaj lahko pove radiolog?
Katarina Šurlan Popovič, Barbara Šijaković
eSinapsa, 2023-24
Možganska omrežja pri nevrodegenerativnih boleznih
Tomaž Rus, Matej Perovnik
Morske živali kot navdih za nevroznanstvenike: morski konjiček, morski zajček in klobučnjak
Tina Bregant
Metoda Feldenkrais: gibanje in nevroplastičnost
Mateja Pate
Etično naravnana animalna nevroznanost
Maša Čater
Helena Motaln, Boris Rogelj
eSinapsa, 2023-25
Urban Košak, Damijan Knez, Anže Meden, Simon Žakelj, Jurij Trontelj, Jure Stojan, Maja Zakošek Pipan, Kinga Sałat idr.
eSinapsa, 2024-26
Naravno okolje kot vir zdravja in blagostanja
Karin Križman, Grega Repovš, Gaja Zager Kocjan, Gregor Geršak
Katja Peganc Nunčič, Damjan Osredkar
Tanja Goltnik
Ali je zgodnje vstajanje dedno?
Cene Skubic, Laura Plavc, Damjana Rozman, Leja Dolenc Grošelj
Mejno osebnostno motnjo (MOM) opredeljujejo ekstremna občutljivost na realne ali navidezne medosebne zavrnitve, nestabilna samopodoba in močno nihanje samozavesti, intenzivni in vzkipljivi čustveni odzivi ter impulzivna ravnanja, ki so pogosto samouničevalna. MOM se sicer v splošni populaciji pojavlja v podobnem deležu kot ostale osebnostne motnje, a je zaradi visoke komorbidnosti pogostejša med nevrotičnimi in psihotičnimi bolniki. Velik problem te motnje sta težavna diagnoza in pomanjkanje specifičnega farmakološkega zdravljenja. Pogosto je tudi zavračanje psiho- in socioterapije s strani bolnikov, kar je posledica ene od značilnosti te motnje, tj. zavračanje odgovornosti in nesprejemanje posledic lastnih ravnanj. Medtem ko medicinska in zdravstvena stroka MOM obravnavata predvsem iz epidemiološkega, demografskega, sociološkega, diagnostičnega, terapevtskega in prognostičnega vidika, se biološke znanosti ukvarjajo z iskanjem njenih temeljnih vzrokov, s poudarkom na razlagi molekularne, celične in tkivne patofiziologije možganov. V tem prispevku so okvirno predstavljene dosedanje ugotovitve o okoljskih in genetskih predispozicijah za njen razvoj ter kaj se pri tej motnji dogaja v samih možganih.
Patofiziologija in simptomatika
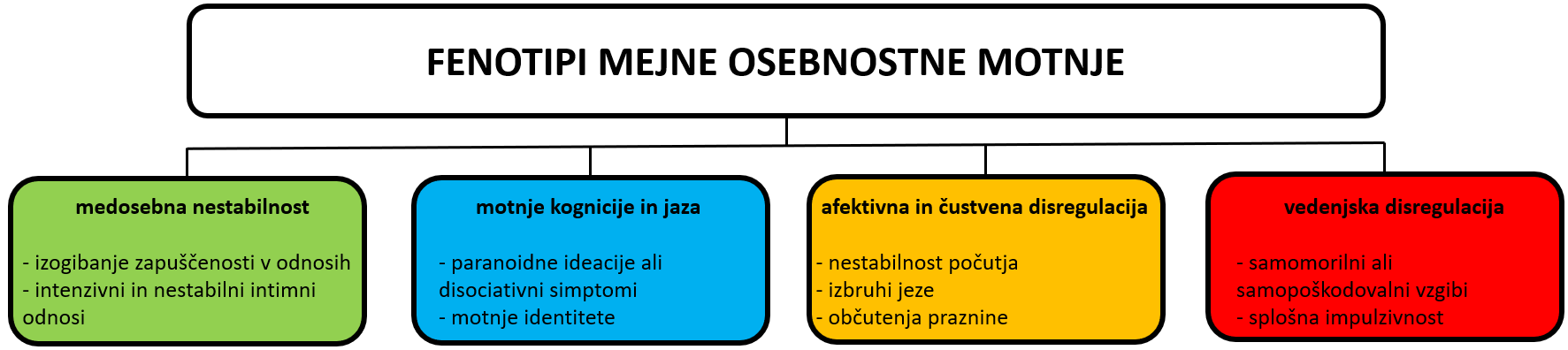
Nevrobiološki model MOM predlaga fenotipe, ki so produkt interakcij med genetiko posameznika in okoljskega vpliva (angl. »gene-environment interactions«). Te interakcije v času otroštva vplivajo na anatomsko-funkcionalni razvoj možganov preko delovanja hormonov in nevropeptidov, le-ta pa pogojuje osebnostne in značajske poteze, ki ostanejo precej stabilne tekom življenja 1. Za MOM je značilna predvsem prefrontalno-limbična disfunkcija, saj bistveno vpliva na negativno afektivnost v kontekstu socialnega stresa (glej razdelek Nevrološke implikacije). Zaradi raznolikosti v pojavnosti in intenziteti simptomatike se je za MOM uveljavila delitev v štiri fenotipe, ki so lahko prisotni v različnih intenzitetah (slika 1).
Za fenotip medosebne nestabilnosti so značilni nestabilni in konfliktni intimni odnosi ter nihanje med pretiranim družabnim vključevanjem in socialno izolacijo. Bolniki z MOM so v eni fazi močno navezani na določenega posameznika in se v odnosu do njega vedejo odvisniško, ko pa se jim zazdi, da njihovim potrebam ni zadoščeno, postanejo zelo manipulativni in zahtevni. Bolniki imajo dramatična nihanja v dojemanju ljudi, s katerimi so čustveno povezani – ko jim potrebe izpolnjujejo, jih idealizirajo in obožujejo, ko pa se počutijo razočarane, spregledane ali zapuščene, jih povsem razvrednotijo. Težave imajo pri prepoznavanju potreb in čustev drugih, preobčutljivi so na socialne grožnje. Za MOM je zelo značilen strah pred zavrnitvijo s strani drugih ljudi, ta strah je pogosto pretiran in neutemeljen. V želji, da bi se zavrnitvi izognili, lahko postanejo zelo zahtevni do druge osebe, se je začnejo oklepati ali ji celo groziti, s čimer pa zavrnitev seveda le še pospešijo.
Za fenotip motene kognicije in jaza je značilna osiromašena, nerazvita ali nestanovitna samopodoba, ki jo spremlja kroničen občutek praznine. Samozavest je nizka, samokritičnost in občutek sramu sta visoka. Osebni cilji, težnje, hotenja in vrednote ter karierni načrti so nekonsistentni, če pa se že uresničujejo, to deluje neprepričljivo. Bolniki lahko imajo moteno kognicijo v obliki prehodnih paranoidnih ideacij in disociativnih simptomov.
V sklopu afektivnega in čustveno disreguliranega fenotipa so bolniki z MOM čustveno labilni in v medosebnih odnosih reagirajo z intenzivno doživetimi in izraženimi disforičnimi čustvi v depresivnih, anksioznih ali razdražljivih oblikah. Značilne so intenzivne, socialno nesprejemljive oblike izbruhov jeze, ki lahko navkljub pomirjujočemu ali umikajočemu ravnanju drugih vodijo v različna nasilna vedenja, tudi fizično.
Vedenjska disregulacija bolnikov z MOM temelji na šibki kontroli impulzov in predstavlja tveganje za samopoškodovalna vedenja, bodisi neposredna in hitro uničujoča (lahkomiselne »adrenalinske« dejavnosti, telesno samopoškodovanje, poskusi samomorov), bodisi dolgoročno samouničujoča (zapravljivost, hazarderstvo, promiskuitetne spolne prakse, zloraba psihoaktivnih substanc, prenajedanje). Za razliko od ostalih fenotipov se karakteristike vedenjske deregulacije pojavljajo le v obdobjih distresa.
Okoljski dejavniki tveganja
Morda najmočneje so z MOM povezane negativne socialne interakcije v otroštvu, predvsem tiste z izrazito čustveno komponento (običajno primarne družine). Najbolj raziskovane so povezave med pojavnostjo MOM in slabimi vzgojnimi praksami staršev, kot so fizično, psihično ali spolno nasilje, zanemarjanje, zapustitev ter pretirano popustljiva ali stroga vzgoja 2, 3, 4, 5. A neustrezna vzgoja ne rezultira direktno v pojavnosti MOM, ampak preko vzpostavljanja osebnostne strukture s specifično kombinacijo jakosti dimenzij po modelu »velikih pet faktorjev osebnosti« (visok nevroticizem, nihajoča ekstravertnost in nizka sprejemljivost, vestnost in odprtost) utrjuje pogoje za razvoj MOM 6.
Genetski dejavniki tveganja
Dednost obolenja za MOM je visoka. Študije na dvojčkih so pokazale faktor dednosti ≈0,70 7, 8, 9. Prva asociacijska študija na celotnem genomu (GWAS) je pokazala genetsko prekrivanje z bipolarno motnjo, shizofrenijo in depresijo 10, z implikacijo na gene DPYD, PKP4 in SERINC5, ki učinkujejo na osnovne lastnosti živčnega prenosa signala (npr. celična adhezija, mielinizacija). Nasprotno pa predhodna meta-analiza ni pokazala povezave z geni, ki običajno kažejo na podvrženost k različnim psihiatričnim motnjam, kot so SLC6A4, TPH1 in HTR1B 11.
Pomembna je študija, ki je za kandidatne gene izbrala 10 tistih, ki sestavljajo signalno os hipotalamus-hipofiza-nadlevična žleza (HHN) 12. Os HHN sodeluje pri zgodnjem odzivanju na stres in je že bila povezana s tveganji za razvoj drugih psihiatričnih motenj. Nekateri polimorfizmi enega nukleotida genov FKBP5 in CRHR ter njune haplotipne kombinacije so diferencialno prisotne pri bolnikih z MOM in zdravih osebah, druge pa pri bolnikih z MOM, ki so doživeli zlorabe v otroštvu in pri tistih, ki jih niso. Spremenjeno delovanje osi HHN je odgovorno za nestabilno regulacijo afektov preko hiperaktivnosti amigdale pri zaznavi groženj 13 in posledičnega povečanega sproščanja kortizola 14, česar rezultat je negativen stresni odziv.
Epigenetski dejavniki tveganja
Zaradi evidentne etiologije zlorab v otroštvu na razvoj MOM so v zadnjem času aktualne epigenetske raziskave, ki bi lahko pojasnile značilne simptome. Narejena je bila metilacijska analiza na celem genomu (angl. Genome-Wide Methylation Analysis, GWMA), ki je identificirala 14 genov z različnim obsegom metilacije predelov CpG, bodisi v primerjavi med zlorabljeno in kontrolno kohorto, bodisi v povezavi z različno intenziteto zlorab 15. Najbolj je izstopal gen MIR124‐3 z zapisom za miRNK, katere tarča so geni, udeleženi pri uravnavanju nevronske plastičnosti in delovanju amigdale (npr. NR3C1).
Druga študija je izpostavila povezavo povečane metilacije gena za nevrotrofični dejavnik možganskega izvora (angl. Brain-Derived Neurotrophic Factor, BDNF) z zlorabami v otroštvu in podvrženostjo za razvoj MOM 16. BDNF ima pomembno vlogo pri diferenciaciji novih nevronov in pri ohranjanju vitalnosti obstoječih ter pri zagotavljanju sinaptične plastičnosti. Njegova ustrezna aktivnost je še posebej ključna pri zgodnjem razvoju.
Nevrološke implikacije
Pri osebah z MOM so v odvisnosti od prevladujočega fenotipa identificirali spremenjeno delovanje različnih nevralnih omrežij (slika 2).
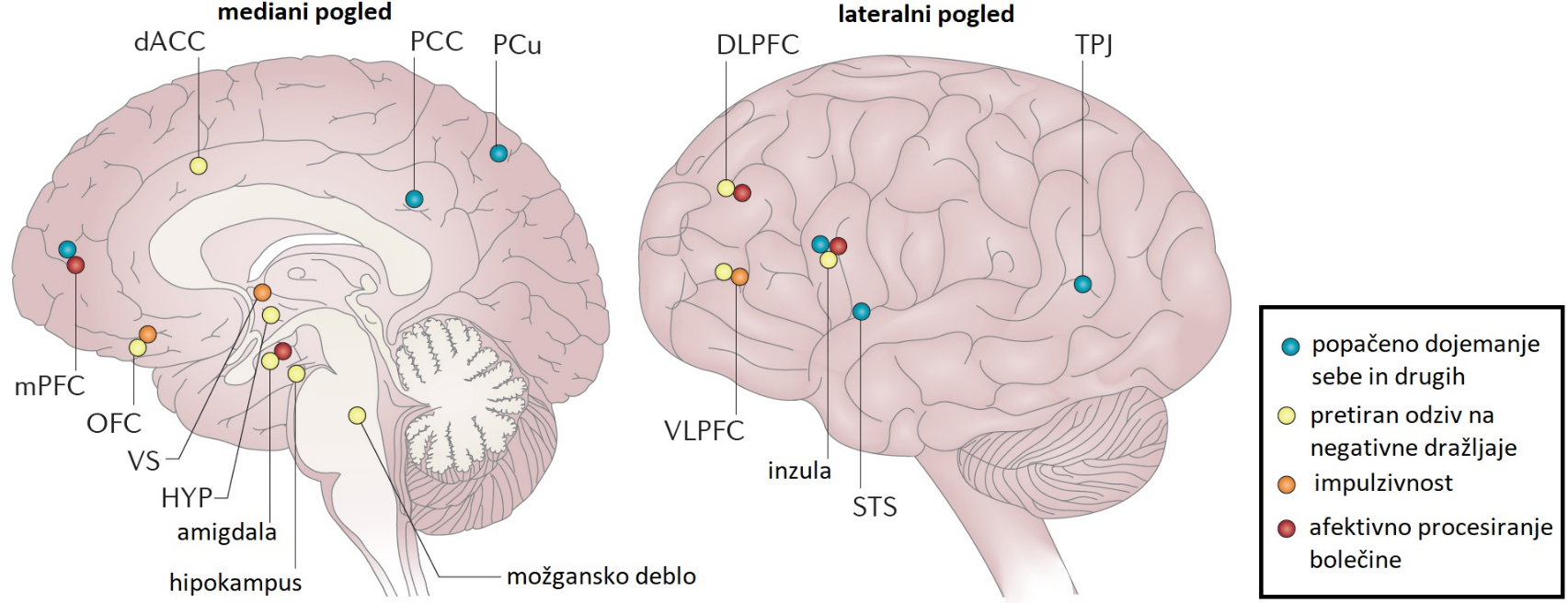 Slika 2: Spremembe v nevralnem mreženju pri mejni osebnostni motnji (prirejeno po Gunderson s sod., 2018).
Slika 2: Spremembe v nevralnem mreženju pri mejni osebnostni motnji (prirejeno po Gunderson s sod., 2018). Funkcionalne spremembe v medialnem prefrontalnem korteksu (mPFC), temporoparietalnem stiku (TP), posteriornem cingulatnem korteksu (PCC) in precuneusu (PCu) so udeleženi pri popačenem dojemanju sebe in drugih 17, 18. Povečana signalizacija med temi predeli in amigdalo ter zmanjšana signalizacija med njimi in superiornim temporalnim sulkusom (STS) sta odgovorni za hipermentalizacijo (tj. pretirana interpretacija zavednih stanj) in za prizadeto dojemanje mentalnega stanja o sebi in drugih 19, 20. Spremenjeno afektivno procesiranje bolečine in pretiran odziv na negativne socialne dražljaje si delita hiperaktivnost amigdale 21, disfunkcionalno prefrontalno procesiranje, prizadeto prefrontalno in limbično povezavo 22 ter povečano komunikacijo med inzulo in dorzolateralnim prefrontalnim korteksom. Poudarjena impulzivnost je posledica motenj v delovanju nagrajevalnega mehanizma, uravnavanega v ventralnem striatumu (VS) 23 in sistemov vedenjske samokontrole, uravnavanih v ventrolateralnem prefrontalnem korteksu (VLPFC), orbitofrontalnem korteksu (OFC) in VS. Če povzamemo, je za MOM najbolj značilna ovirana koordinacija med možganskimi področji za socialno kognicijo in regulacijo čustev 24.
Zaključek
Namen tega prispevka je kratko in jedrnato opisati MOM, za zahtevnejše bralce so poglobljene in razširjene informacije podane drugje 25, 26. Kot kaže, imajo genetski dejavniki tveganja na eni strani nizko penetranco, na drugi strani pa je predvsem od okolja odvisno, ali bo šla klinična slika posameznika v smer razvoja MOM ali katere od psihiatričnih bolezni. Pri motnji MOM ni težavna le diagnostika, temveč tudi proces zdravljenja. Dinamika na nivoju možganov je kompleksna in le skupek različnih nevroloških procesov karakterizira MOM. Je pa MOM zanimiva še z enega vidika. Če na eni strani ločimo osebnostne motnje, ki so pretežno subklinične, in nevroze/psihoze, ki so načeloma klinično dobro definirane, lahko opazimo, da je MOM praktično edina osebnostna motnja, ki nima neposrednega analoga oz. »podaljška« v nevrozah in psihozah. Zaradi genetskih podobnostih se lahko razvije v katerokoli izmed njih, lahko pa v pravih okoliščinah tudi povsem izzveni. V tem smislu je dobila tudi ime: osebnostna motnja na meji tega in onega.
-
___
-
Cattane N, Rossi R, Lanfredi M, Cattaneo A. Borderline personality disorder and childhood trauma: exploring the affected biological systems and mechanisms. BMC Psychiatry. 2017;17:221. ↩
-
Johnson JG, Cohen P, Brown J, Smailes EM, Bernstein DP. Childhood maltreatment increases risk for personality disorders during early adulthood. Arch Gen Psychiatry. 1999;56:600. ↩
-
Johnson JG, Cohen P, Chen H, Kasen S, Brook JS. Parenting behaviors associated with risk for offspring personality disorder during adulthood. Arch Gen Psychiatry. 2006;63:579. ↩
-
Crawford TN, Cohen PR, Chen H, Anglin DM, Ehrensaft M. Early maternal separation and the trajectory of borderline personality disorder symptoms. Dev Psychopathol. 2009;21:1013. ↩
-
Fonagy P, Bateman A. The development of borderline personality disorder – a mentalizing model. J Pers Disord. 2008;22:4–21. ↩
-
Rogosch FA, Cicchetti D. Child maltreatment and emergent personality organization: perspectives from the five-factor model. J Abnorm Child Psychol. 2004;32;123-145. ↩
-
Torgersen S, Lygren S, Øien PA, et al. A twin study of personality disorders. Compr. Psychiatry. 2000;41:416-425. ↩
-
Grant BF, Chou SP, Goldstein RB, et al. Prevalence, correlates, disability, and comorbidity of DSM IV borderline personality disorder: results from the Wave 2 National Epidemiologic Survey on Alcohol and Related Conditions. J Clin Psychiatry. 2008;69:533-545. ↩
-
Kaess M, Brunner R, Chanen A. Borderline personality disorder in adolescence. Pediatrics. 2014;134:782-793. ↩
-
Witt SH, Streit F, Jungkunz M, et al. Genome-wide association study of borderline personality disorder reveals genetic overlap with bipolar disorder, major depression and schizophrenia. Transl Psychiatry. 2017;7:e1155. ↩
-
Amad A, Ramoz N, Thomas P, Jardri R, Gorwood P. Genetics of borderline personality disorder: systematic review and proposal of an integrative model. Neurosci Biobehav Rev. 2014;40:6-19. ↩
-
Martín-Blanco A, Ferrer M, Soler J, et al. The role of hypothalamus–pituitary–adrenal genes and childhood trauma in borderline personality disorder. Eur Arch Psychiatry Clin Neurosci. 2015;266:307-316. ↩
-
Di Lorio CR, Carey CE, Michalski LJ et al. Hypothalamic-pituitary-adrenal axis genetic variation and early stress moderates amygdala function. Psychoneuroendocrinology. 2017;80:170-178. ↩
-
Cattane N, Rossi R, Lanfredi M, Cattaneo A. Borderline personality disorder and childhood trauma: exploring the affected biological systems and mechanisms. BMC Psychiatry. 2017;17:221. ↩
-
Prados J, Stenz L, Courtet P, et al. Borderline personality disorder and childhood maltreatment: a genome-wide methylation analysis. Genes Brain Behav. 2015;14:177-188 (2015). ↩
-
Perroud N, Salzmann A, Prada P, et al. Response to psychotherapy in borderline personality disorder and methylation status of the BDNF gene. Transl Psychiatry. 2013;3:e207–e207. ↩
-
Krause-Utz A, Elzinga BM, Oei NY, et al. Amygdala and dorsal anterior cingulate connectivity during an emotional working memory task in borderline personality disorder patients with interpersonal trauma history. Front Hum Neurosci. 2014;8:848. ↩
-
Beeney JE, Hallquist MN, Ellison WD, Levy KN. Self-other disturbance in borderline personality disorder: neural, self-report, and performance-based evidence. Personal Disord. 2016;7:28-39. ↩
-
Bilek E, Stößel G, Schäfer A, et al. State-dependent cross-brain information flow in borderline personality disorder. JAMA Psychiatry. 2017;74:949-957. ↩
-
Haas BW, Miller JD. Borderline personality traits and brain activity during emotional perspective taking. Personal Disord. 2015;6:315-320. ↩
-
Schulze L, Schmahl C, Niedtfeld I. Neural correlates of disturbed emotion processing in borderline personality disorder: a multimodal meta analysis. Biol Psychiatry. 2016;79:97-106. ↩
-
Herpertz SC, Nagy K, Ueltzhöffer K, et al. Brain mechanisms underlying reactive aggression in borderline personality disorder-sex matters. Biol Psychiatry. 2017;82:257-266. ↩
-
Herbort MC, Soch J, Wüstenberg T, et al. A negative relationship between ventral striatal loss anticipation response and impulsivity in borderline personality disorder. NeuroImage Clin. 2016;12:724-736. ↩
-
O’Neill A, D’Souza A, Samson AC, Carballedo A, Kerskens C, Frodl T. Dysregulation between emotion and theory of mind networks in borderline personality disorder. Psychiatry Res. 2015;231:25-32. ↩
-
Gunderson JG, Herpertz SC, Skodol AE, Torgersen S, Zanarini MC. Borderline personality disorder. Nat Rev Dis Primers. 2018;4:18029. DOI: http://dx.doi.org/10.1038/nrdp.2018.29 ↩
-
Leichsenring F, Leibing E, Kruse J, New AS, Leweke F. Borderline personality disorder. Lancet. 2011;377:74-84. DOI: https://doi.org/10.1016/S0140-6736(10)61422-5 ↩
ddr. Matjaž Deželak, univ. dipl. biol.
SiNAPSA, slovensko društvo za nevroznanost
Sprejeto: 15.3.2020
Objavljeno: 16.4.2020